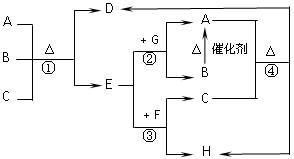
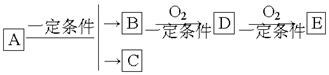
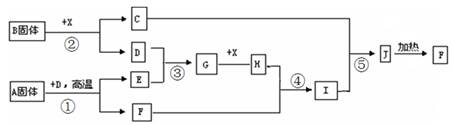
题目内容
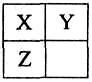
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是


| A.X、Y、Z的原子半径大小:X>Y>Z |
| B.Y、Z的气态氢化物中,前者更稳定 |
| C.Z、W的最高价氧化物对应水化物的酸性,前者更强 |
| D.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键 |
BD
Y原子的最外层电子数是其次外层电子数的3倍,则Y是O。所以根据元素在周期表中的位置可知,X是N,Z是S,W是Cl。同周期自左向右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,因此X、Y、Z的原子半径大小顺序是Z>X>Y,A不正确。同主族自上而下非金属性逐渐减弱,氢化物的温度下逐渐减弱,B正确。非金属性压强,最高价氧化物的水化物的酸性越强,氯的非金属性强于S的,所以高氯酸的酸性强于硫酸的,C不正确。X、W的气态氢化物分别是氨气和氯化氢,二者反应生成氯化铵,含有离子键和共价键,D正确,答案选BD。

练习册系列答案
相关题目

 )和甲胺(
)和甲胺(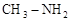 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):