题目内容
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜,当两装置电路中通过的电子都是1mol时,下列说法不正确的是
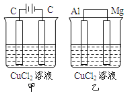
A.溶液的导电能力变化:甲>乙
B.溶液的质量减小程度:甲>乙
C.甲中阴极和乙中镁电极上析出物质质量:甲=乙
D.电极反应式:甲中阳极:2Cl--2e-=Cl2↑
【答案】C
【解析】
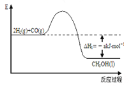
试题分析:甲为电解池,乙为原电池,甲中总反应为:CuCl2![]() Cu+Cl2↑,乙中总反应为:Mg+Cu2+=Cu+Mg2+,当两装置电路中通过的电子都是1mol时;A.甲为电解电解质的反应,溶液中离子浓度减小,乙为原电池反应,电荷浓度不变,所以溶液的导电能力变化:甲>乙,故A正确;B.甲溶液中,阳极上析出35.5g氯气,阴极上生成32gCu,通过1mol电子时,溶液质量减少67.5g,乙中溶液中负极溶解12gMg,正极析出32gCu,溶液质量减少20g,所以溶液的质量减小程度:乙<甲,故B正确;C.甲中阴极析出Cu,乙中镁电极溶解,所以质量不相同,故C错误;D.甲中阳极上氯离子放电,乙中正极上铜离子放电,电极反应式为甲中阳极:2Cl--2e→Cl2↑,故D正确;故选C。
Cu+Cl2↑,乙中总反应为:Mg+Cu2+=Cu+Mg2+,当两装置电路中通过的电子都是1mol时;A.甲为电解电解质的反应,溶液中离子浓度减小,乙为原电池反应,电荷浓度不变,所以溶液的导电能力变化:甲>乙,故A正确;B.甲溶液中,阳极上析出35.5g氯气,阴极上生成32gCu,通过1mol电子时,溶液质量减少67.5g,乙中溶液中负极溶解12gMg,正极析出32gCu,溶液质量减少20g,所以溶液的质量减小程度:乙<甲,故B正确;C.甲中阴极析出Cu,乙中镁电极溶解,所以质量不相同,故C错误;D.甲中阳极上氯离子放电,乙中正极上铜离子放电,电极反应式为甲中阳极:2Cl--2e→Cl2↑,故D正确;故选C。

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目