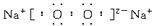题目内容
已知:下列各种物质都由短周期元素组成,它们之间的关系如下图所示。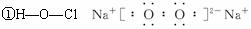
常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应。C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应呈黄色。请回答:
①P的结构式为__________________,B的电子式为:__________________
②R水溶液呈碱性的原因可用离子方程式表示为____________________________________。
③还有一种物质能与B反应生成C,写出这个反应的化学方程式_______________________。
④还有一种物质能与J反应生成C,写出这个反应的化学方程式_______________________。
⑤某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出发生的离子反应方程式________________________。
![]()
②![]() +2H2O
+2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
③2CO2+2Na2O2====2Na2CO3+O2
④2F2+2H2O====4HF+O2
⑤Cl2+SO2+2H2O====4H++2Cl-+![]()
解析:H为Cl2,C、H、M为气体单质:M为H2,C为O2,A为Na,L为NaOH,B为Na2O2,F为Al,K为NaClO,N为HCl,P为HClO,结构式:H—O—Cl;B电子式为:![]()
(2)R为NaOH和Al生成的NaAlO2,水溶液显碱性,原因:![]() +2H2O
+2H2O![]() Al(OH)3+OH-。
Al(OH)3+OH-。
(3)丁为H2O,所以Na2O2还能与CO2反应:2Na2O2+2CO2====2Na2CO3+O2。
(4)除Na2O2与H2O生成O2外,还有F2能置换水中O2,2F2+2H2O====4HF+O2。
(5)有漂白性的物质大多有强氧化性,能与Cl2反应必有还原性,所以是SO2,Cl2+SO2+2H2O====2HCl+H2SO4,写成离子方程式:Cl2+SO2+2H2O====4H++Cl-+![]() 。
。

 天天练口算系列答案
天天练口算系列答案

 ?
?