题目内容
【题目】常用CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。
(1)基态Cu2+核外电子排布式为_________。
(2)CH3COONa中碳原子轨道的杂化类型是______,1 mol CH3COONa中含有σ键的数目为_______。
(3)与OH- 离子互为等电子体的阴离子为________。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为_________。
(5)Cu2O 晶体结构可能是________(填字母)。

【答案】 1s22s22p63s23p63d9 sp3 sp2 6NA HS- 乙酸钠是离子晶体,乙酸、乙醛是分子晶体,所以乙酸钠的沸点最高,乙酸分子间含有氢键,所以乙酸的沸点大于乙醛; A
【解析】试题(1)Cu2+核外有27个电子;(2)CH3COONa中甲基上的碳原子为单键碳,羧基上的碳原子有1个碳氧双键;共价单键是σ键,双键中有1个σ键、1个π键;(3)等离子体是原子数相同、价电子数相同的微粒;乙酸钠是离子晶体,乙酸、乙醛是分子晶体,乙酸分子间含有氢键;(5)Cu2O属于离子晶体,A中原子个数比是1:2,B中原子个数比是1:1。
解析:(1)Cu2+核外有27个电子,根据能量最低原理,基态Cu2+核外电子排布式为1s22s22p63s23p63d9;(2)CH3COONa中甲基上的碳原子为单键碳,该碳原子为sp3杂化,羧基上的碳原子有1个碳氧双键,该碳原子为sp2杂化;共价单键是σ键,双键中有1个σ键、1个π键,CH3COONa中含有5个单键和一个碳氧双键,所以1 mol CH3COONa中含有σ键的数目为6NA;(3)等离子体是原子数相同、价电子数相同的微粒,与OH- 离子互为等电子体的阴离子为HS-;乙酸钠是离子晶体,乙酸、乙醛是分子晶体,所以乙酸钠的沸点最高,乙酸分子间含有氢键,所以乙酸的沸点大于乙醛;(5)Cu2O属于离子晶体,A中原子个数比是1:2,B中原子个数比是1:1,所以Cu2O 晶体结构可能是A。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
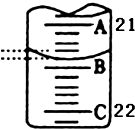
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.