题目内容
下列叙述中不正确的是
| A.向氯化钙溶液中通入少量CO2,有白色沉淀CaCO3生成 |
| B.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| C.向NaAlO2溶液中通入过量CO2,有白色胶状沉淀析出 |
| D.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下生成CO2体积比为53∶42 |
A
解析试题分析:A、向氯化钙溶液中通入少量CO2,二者不反应,没有白色沉淀CaCO3生成,A不正确;B、由于碳酸氢钠的溶解度小于碳酸钠的溶解度,所以向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出,B正确;C、氢氧化铝不能溶解在碳酸中,所以向NaAlO2溶液中通入过量CO2,有白色胶状氢氧化铝沉淀析出,C正确;D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,则根据碳原子守恒可知,在同温同压下生成CO2体积比= :
: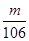 =53∶42,D正确,答案选A。
=53∶42,D正确,答案选A。
考点:考查化学反应原理判断以及碳酸盐与盐酸反应生成CO2体积的计算

练习册系列答案
相关题目
下列有关物质的性质与应用不相对应的是
| A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 |
| D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 |
以下转化能通过一步反应实现的是
| A.Al2O3→Al(OH)3 | B.SiO2 →H2SiO3 | C.Fe→FeCl2 | D.NaCl→NaOH |
下列推断正确的是
| A.SiO2是酸性氧化物,能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下列物质的转化在给定条件下能实现的是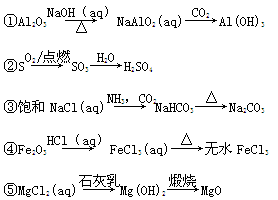
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
实验是化学研究的基础。对下列实验现象的描述错误的是
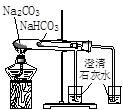 | 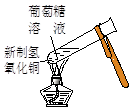 | 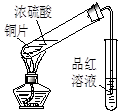 | 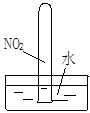 |
| ① | ② | ③ | ④ |
A.实验①烧杯中的澄清石灰水都变浑浊
B.实验②试管中出现砖红色沉淀
C.实验③品红溶液褪色
D.实验④气体由红棕色变为无色,试管中的液面上升
通过对实验现象的观察、分析推理得出正确的结论是化学 学习的方法之一。对下列实验事实解释正确的是
| | 现象 | 解释 |
| A. | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B. | 浓HNO3在光照条件下变黄 | 浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
| C. | 某溶液中加入硝酸酸化的氯化钡溶液, 有白色沉淀生成 | 说明该溶液中含有SO42- |
| D. | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
下列叙述不正确的是( )
| A | B | C | D |
 |  |   |  |
| 闪电时会发生反应: N2 + O2  2NO 2NO | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
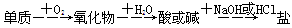 ,能实现上述物质间直接转化的元素
,能实现上述物质间直接转化的元素
| A.硅 | B.硫 | C.铜 | D.铁 |