题目内容
14.某学生为了测定部分变质的Na2SO3样品的纯度.按图1所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4至完全反应;然后,将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g.回答下列问题:
(1)实验开始时,应先点燃D处酒精灯(填装置字母).
(2)实验开始后,写出B中反应的离子方程式Cl2+SO2+2H2O═4H++2Cl-+SO42-.
(3)C中的现象是红色鲜花褪色,E装置的作用是吸收未反应的二氧化硫和氯气.
(4)按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度偏低(填“偏高”、“偏低”或“无影响”).据图2计算原样品中Na2SO3的纯度为50.8%(精确到0.1%).
分析 A装置产生二氧化硫,D装置产生氯气在F装置中干燥,C装置检验干燥氯气的漂白性,氯气和二氧化硫在B装置中反应,E装置吸收尾气,防止污染空气,
(1)应先准备氯气,保证二氧化硫被完全氧化
(2)A为实验室制备二氧化硫的发生装置,D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(3)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用;氯气和二氧化硫有毒,E中NaOH溶液吸收尾气防止污染;
(4)按题给装置和操作进行实验,二氧化硫与氯气不一定能充分接触,使得二氧化硫有可能没有完全被氧化而被氢氧化钠吸收,导致硫酸钡质量减少,据此分析,根据图示读取样品质量,根据硫元素守恒计算,Na2SO3~SO2~BaSO4,据此计算.
解答 解:(1)应先准备氯气,保证二氧化硫被完全氧化,故先加热D处酒精灯,
故答案为:D;
(2)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑2H2O,A中是实验室制备二氧化硫的装置,反应的化学方程式为:H2SO4+Na2SO3═Na2SO4+H2O+SO2↑,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(3)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用,故红色鲜花褪色;氯气和二氧化硫有毒,二氧化硫在溶液中反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;氯气在其溶液中反应生成NaCl和NaClO,反应为:Cl2+2OH-═Cl-+ClO-+2H2O,故E中NaOH溶液吸收尾气防止污染;
故答案为:红色鲜花褪色;吸收未反应的二氧化硫和氯气;
(4)按题给装置和操作进行实验,二氧化硫与氯气不一定能充分接触,使得二氧化硫有可能没有完全被氧化而被氢氧化钠吸收,导致硫酸钡质量减少,则由此计算的亚硫酸钠的质量减少,质量分数偏低,
根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m 23.3g
m=$\frac{126g×23.3g}{233g}$=12.6g,
样品质量为:10.0g+10.0g+5.0g-0.2g=24.8g,
所以Na2SO3的质量分数为 $\frac{12.6g}{24.8g}$×100%=50.8%,
故答案为:偏低;50.8%.
点评 本题考查实验基本操作、二氧化硫和氯气的性质,较基础,注意从实验目的考虑加热的先后顺序,抓住原子守恒进行计算,难度中等.

| A. | 碱--①④ | B. | 电解质--③④⑤ | C. | 混合物--②③ | D. | 盐--②⑥ |
| A. | 铁跟稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应 Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应 CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应 MgCO3+2H+═Mg2++H2O+CO2↑ |
| A. | 将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| B. |  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备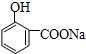 | |
| C. | 用分液法分离苯和液溴的混合物 | |
| D. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
| A. | 铁栏杆表面涂上一层油漆可防腐蚀 | |
| B. | 自行车钢圈和车铃上镀铬可防腐蚀 | |
| C. | 铁在沙漠中比在海边更易锈蚀 | |
| D. | 铁制品发生电化学腐蚀时负极反应为:Fe-2e-=Fe2+ |

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.
盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+;.
(4)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| C. | 在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
 ,其反应类型为取代反应.
,其反应类型为取代反应.