题目内容
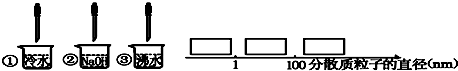
(1)少量饱和氯化铁溶液分别滴加到如图所示的三种物质中得到三种分散系①、②、③.试将①、②、③填入如图方框中:
(2)在饱和氯化铁溶液中加入铁粉末,发现溶液颜色由棕黄色变浅绿色.用离子方程式表示产生上述现象的原因
(3)在Fe(OH)3胶体中,逐滴加入稀盐酸溶液.出现的现象是:先产生红褐色沉淀,其原因是
(4)在Fe(OH)3胶体中,逐滴加入HI稀溶液.出现的现象是:先产生红褐色沉淀,随后沉淀溶解,沉淀溶解的离子方程式为
(5)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体.用离子方程式表示产生上述现象的原因

(2)在饱和氯化铁溶液中加入铁粉末,发现溶液颜色由棕黄色变浅绿色.用离子方程式表示产生上述现象的原因
2Fe3++Fe=3 Fe2+
2Fe3++Fe=3 Fe2+
.(3)在Fe(OH)3胶体中,逐滴加入稀盐酸溶液.出现的现象是:先产生红褐色沉淀,其原因是
HCl是电解质,能引起胶体聚沉
HCl是电解质,能引起胶体聚沉
,随后沉淀溶解,离子方程式为Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)3+3H+=Fe3++3H2O
.(4)在Fe(OH)3胶体中,逐滴加入HI稀溶液.出现的现象是:先产生红褐色沉淀,随后沉淀溶解,沉淀溶解的离子方程式为
2Fe(OH)3+6H++2I-=2Fe2++I2+12H2O
2Fe(OH)3+6H++2I-=2Fe2++I2+12H2O
.(5)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体.用离子方程式表示产生上述现象的原因
2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑
2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑
.分析:(1)依据分散系的本质是微粒直径大小分析;
(2)氯化铁和铁反应生成氯化亚铁;
(3)电解质溶液能引起胶体的聚沉,氢氧化铁和盐酸发生反应生成氯化铁和水;
(4)氢氧化铁和碘化氢反应生成的铁离子和碘离子后悔发生氧化还原反应,据此写出离子方程式;
(5)碳酸钙和氯化铁水解生成的盐酸反应,促进水解正向进行生成氢氧化铁胶体和二氧化碳;
(2)氯化铁和铁反应生成氯化亚铁;
(3)电解质溶液能引起胶体的聚沉,氢氧化铁和盐酸发生反应生成氯化铁和水;
(4)氢氧化铁和碘化氢反应生成的铁离子和碘离子后悔发生氧化还原反应,据此写出离子方程式;
(5)碳酸钙和氯化铁水解生成的盐酸反应,促进水解正向进行生成氢氧化铁胶体和二氧化碳;
解答:解:(1)分散系依据分散质微粒直径大小进行分类,微粒直径在<1nm的分散系为溶液,微粒直径在>100nm的分散系为浊液,微粒直径在1nm--100nm的分散系为胶体;
故答案为:①、③、②;
(2)在饱和氯化铁溶液中加入铁粉末,发现溶液颜色由棕黄色变浅绿色,氯化铁和铁反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3 Fe2+;
故答案为:2Fe3++Fe=3 Fe2+;
(3)电解质溶液能引起胶体的聚沉,先产生红褐色沉淀,氢氧化铁和盐酸发生反应生成氯化铁和水,随后沉淀溶解,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
故答案为:HCl是电解质,Fe(OH)3+3H+=Fe3++3H2O;
(4)在Fe(OH)3胶体中,逐滴加入HI稀溶液.出现的现象是:先产生红褐色沉淀,随后沉淀溶解,是因为氢氧化铁胶体发生聚沉,生成的氢氧化铁沉淀和碘化氢反应生成碘单质和亚铁盐,反应的离子方程式为:2Fe(OH)3+6H++2 I-=2 Fe2++I2+12H2O;
故答案为:2Fe(OH)3+6H++2 I-=2 Fe2++I2+12H2O;
(5)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体,是因为碳酸钙和氯化铁水解生成的盐酸反应,促进水解正向进行生成氢氧化铁胶体和二氧化碳,反应的离子方程式为:2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑;
故答案为:2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑.
故答案为:①、③、②;
(2)在饱和氯化铁溶液中加入铁粉末,发现溶液颜色由棕黄色变浅绿色,氯化铁和铁反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3 Fe2+;
故答案为:2Fe3++Fe=3 Fe2+;
(3)电解质溶液能引起胶体的聚沉,先产生红褐色沉淀,氢氧化铁和盐酸发生反应生成氯化铁和水,随后沉淀溶解,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
故答案为:HCl是电解质,Fe(OH)3+3H+=Fe3++3H2O;
(4)在Fe(OH)3胶体中,逐滴加入HI稀溶液.出现的现象是:先产生红褐色沉淀,随后沉淀溶解,是因为氢氧化铁胶体发生聚沉,生成的氢氧化铁沉淀和碘化氢反应生成碘单质和亚铁盐,反应的离子方程式为:2Fe(OH)3+6H++2 I-=2 Fe2++I2+12H2O;
故答案为:2Fe(OH)3+6H++2 I-=2 Fe2++I2+12H2O;
(5)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体,是因为碳酸钙和氯化铁水解生成的盐酸反应,促进水解正向进行生成氢氧化铁胶体和二氧化碳,反应的离子方程式为:2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑;
故答案为:2Fe3++3CaCO3+3H2O=2Fe(OH)3+3 Ca2++3CO2↑.
点评:本题考查了分散系实质,胶体聚沉的条件分析判断,氧化还原反应分析应用是解题关键,题目难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
