题目内容
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
| A.T1<T2,正反应是放热反应 | B.T1<T2,正反应是吸热反应 |
| C.T1>T2,正反应是放热反应 | D.T1>T2,正反应是吸热反应 |
A
解析试题分析:由图像可知T2先达到拐点,所以T1<T2,排除C、D项;根据纵轴温度越低Z的量越高,确定正反应为放热反应。A对。
考点:化学平衡过程中的图像分析。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
下列事实不能用勒夏特列原理来解释的是
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |
在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
| A.40% | B.50% | C.60% | D.70% |
如图表示外界条件(温度、压力)的变化对下列反应的影响:L(s)+G(g) 2R(g) ΔH>0。在图中Y轴是指
2R(g) ΔH>0。在图中Y轴是指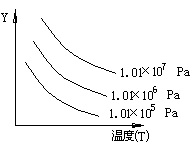
| A.平衡混合气中R的质量分数 | B.G的转化率 |
| C.平衡混合气中G的体积分数 | D.L的转化率 |
对于反应C(s)+H2O(g)  CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为K=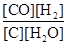 |
| B.增大体系压强,平衡常数K不发生变化 |
| C.升高体系温度,平衡常数K减小 |
| D.增加C(s)的量,平衡正向移动 |
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
| A.①②③④ | B.①③ | C.①② | D.①③④ |
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
| A.产物B的状态可能为固态或液态 |
| B.平衡时,单位时间内A和B消耗的物质的量之比为1:1 |
| C.保持体积不变,向平衡体系中加入A(s),平衡不移动 |
| D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ |
一定条件下,合成氨反应达到平衡状态时,按如下操作,平衡不发生移动的是( )
| A.恒T、P时,充入少量的NH3 | B.恒T、V时,充入少量的N2 |
| C.恒T、P时,充入少量的He | D.恒T、V时,充入少量的He |
 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是