题目内容
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( )
A、甲中由水电离出来的H+的物质的量浓度是乙中由水电离出来的H+的物质的量浓度的
| ||
| B、物质的量浓度c(甲)=10c(乙) | ||
| C、中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙) | ||
| D、甲中的c(OH-)为乙中c(OH-)的10倍 |
分析:A.酸溶液中氢氧根离子只能由水电离,所以水电离出的c(H+)等于溶液中c(OH-);
B.溶液越稀,醋酸的电离程度越大,据此判断酸的浓度大小;
C.中和等物质的量的NaOH溶液,弱酸的浓度越大,消耗酸的体积越小;
D.根据c(OH-)=
进行解答;
B.溶液越稀,醋酸的电离程度越大,据此判断酸的浓度大小;
C.中和等物质的量的NaOH溶液,弱酸的浓度越大,消耗酸的体积越小;
D.根据c(OH-)=
| Kw |
| c(H+) |
解答:解:A.pH=-lgc(H+),c(H+)=10-pH,所以c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(H+)甲=10c(H+)乙,酸溶液中水电离出的c(H+)等于溶液中c(OH-),c(OH-)=
,所以氢氧根离子浓度:10c(OH-)甲=c(OH-)乙,则水电离出的氢离子浓度10c(H+)甲=c(H+)乙,故A正确;
B.弱酸酸的浓度越大,酸的电离程度越小,醋酸为弱酸,c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(甲)>10c(乙),故B错误;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),故C错误;
D.c(OH-)=
,所以氢氧根离子浓度:10c(OH-)甲=c(OH-)乙,故D错误;
故选:A.
| Kw |
| c(H+) |
B.弱酸酸的浓度越大,酸的电离程度越小,醋酸为弱酸,c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(甲)>10c(乙),故B错误;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),故C错误;
D.c(OH-)=
| Kw |
| c(H+) |
故选:A.
点评:本题考查弱电解质乙酸的电离,注意弱电解质的电离程度和浓度的关系是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
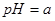 ,乙的
,乙的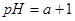 ,对下列叙述的判断正确的是
,对下列叙述的判断正确的是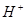 的物质的量浓度是乙中水电离出来的
的物质的量浓度是乙中水电离出来的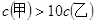
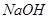 溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)
溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)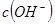 为乙中的
为乙中的