题目内容
【题目】I、按要求书写下列反应的化学方程式或离子方程式:
(1)实验室制备氨气化学方程式_______________;
(2)工业制备漂白粉化学方程式_______________;
(3)二氧化硫与氧气反应化学方程式_______________;
(4)铝与氢氧化钠溶液反应的离子方程式_______________;
(5)磁性氧化铁与稀硝酸反应离子方程式_______________。
II.A~G 的转化关系如下图所示(部分反应物、产物和反应条件未标出)。
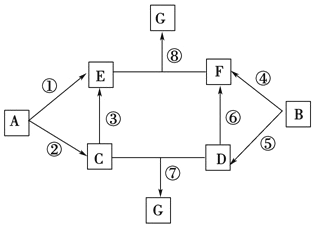
已知:①A、B 为中学化学常见的金属单质,C~G 均为化合物,并且E 和G均含有3 种元素; ②C 是淡黄色固休,D 既能与强酸溶液反应,又能与强碱溶液反应;③F 溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀; ④E 和G 焰色反应均呈黄色。
(1)写出下列物质D 的化学式______;
(2)①~⑥反应中,不属于氧化还原反应的是____________;
(3)将过量的E溶液逐滴加入F 溶液中,出现的现象是____________;
(4)F 和G 溶液混合可以生成白色胶状沉沉,反应的离子方程式为____________;
(5)反应③中,若有31.2gC 参加反应,转移电子的物质的量为________mol。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O 2SO2+O2
CaCl2+2H2O+2NH3↑ 2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O 2SO2+O2![]() 2SO3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 3Fe3O4+NO3-+28H+=NO↑+9Fe3++14H2O Al2O3 ⑥ 先产生白色胶状沉淀,然后沉淀又逐渐溶解 Al3++3AlO2-+6H2O==4Al(OH)3↓ 0.4
2SO3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 3Fe3O4+NO3-+28H+=NO↑+9Fe3++14H2O Al2O3 ⑥ 先产生白色胶状沉淀,然后沉淀又逐渐溶解 Al3++3AlO2-+6H2O==4Al(OH)3↓ 0.4
【解析】I、(1)实验室制备氨气化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;(2)工业制备漂白粉化学方程式为2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;(3)二氧化硫与氧气反应化学方程式为2SO2+O2
CaCl2+2H2O+2NH3↑;(2)工业制备漂白粉化学方程式为2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;(3)二氧化硫与氧气反应化学方程式为2SO2+O2![]() 2SO3;(4)铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)硝酸具有强氧化性,磁性氧化铁与稀硝酸反应离子方程式为3Fe3O4+NO3-+28H+=NO↑+9Fe3++14H2O。
2SO3;(4)铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)硝酸具有强氧化性,磁性氧化铁与稀硝酸反应离子方程式为3Fe3O4+NO3-+28H+=NO↑+9Fe3++14H2O。
II.C是淡黄色固体,应为Na2O2,则A为Na,E含有3种元素,应为NaOH,由钠和水反应生成,D既能与强酸溶液反应,又能与强碱溶液反应,应为Al2O3,则B为Al,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,应生成AgCl,说明F为AlCl3,由转化关系可知G为NaAlO2,则
(1)由以上分析可知D为Al2O3;(2)①②③④⑤都有单质参加反应或有单质生成,一定属于氧化还原反应,⑥反应为Al2O3→AlCl3,可由Al2O3与盐酸反应生成,不是氧化还原反应;(3)氢氧化铝是两性氢氧化物,因此将过量的氢氧化钠溶液逐滴加入氯化铝溶液中,出现的现象是先产生白色胶状沉淀,然后沉淀又逐渐溶解;(4)F和G溶液混合可以生成白色胶状沉沉,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;(5)反应③是:2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠既是氧化剂,也是还原剂,1mol过氧化钠转移1mol电子,31.2g过氧化钠是0.4mol,则转移电子的物质的量为0.4mol。