题目内容
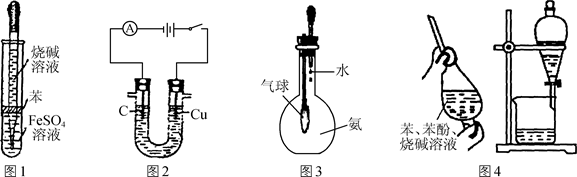
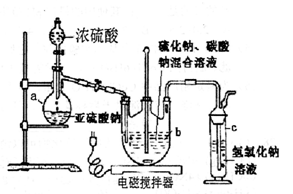
用下列实验装置进行的相应实验,能达到实验目的的是
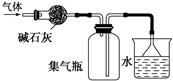
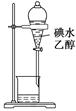
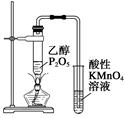
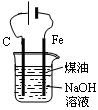
图1 图2 图3 图4




图1 图2 图3 图4
| A.图1所示装置可干燥、收集氨气,并吸收多余的氨 |
| B.图2所示装置可萃取碘水中的碘 |
| C.图3所示装置可证明乙醇发生消去反应生成了乙烯 |
| D.图4所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
A
试题分析:A、氨气用碱石灰干燥,再用向下排空气法收集,多余的氨气用水吸收,倒放的漏斗可防止倒吸,正确;B、乙醇与水互溶,不能萃取碘水中的碘,错误;C、乙醇在浓硫酸作催化剂、加热条件下发生消去反应生成乙烯,而不是浓磷酸,错误;D、制备氢氧化亚铁时铁作阳极,与电源的正极相连,错误,答案选A。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目



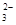 =2I-+S4O
=2I-+S4O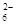 ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表: