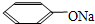
题目内容
将一小块钠投入下列物质的水溶液中,既能生成气体,又有白色沉淀生成的是
- A.MgSO4
- B.BaCl2
- C.H2SO4
- D.CuSO4
A

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、汽油是纯净物,乙醇汽油是混合物 | B、碳酸氢钠溶液可用于区分乙酸、乙醇和苯 | C、向Na2SiO3溶液中通入CO2至过量,溶液先变浑浊后变澄清 | D、将一小块金属钠投入无水乙醇中,钠块浮在液面上四处游动 |