题目内容
(10分)铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
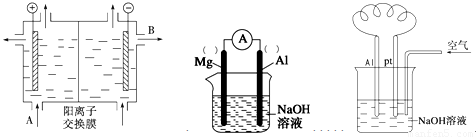
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。?
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
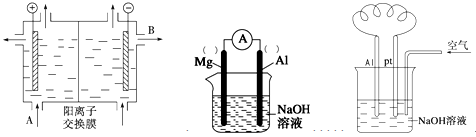
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为___________________________________。
解析:

练习册系列答案
相关题目

 B____________________
B____________________