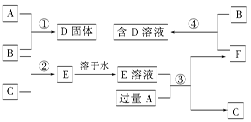题目内容
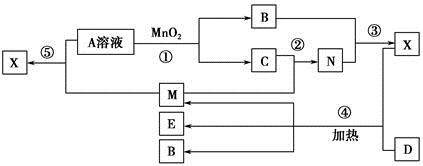
(10分)已知:用惰性电极电解某盐X的溶液,发生的反应为:
X+H2O  A(单质)+B(单质)+Y(化合物)
A(单质)+B(单质)+Y(化合物)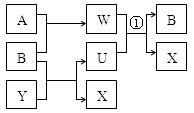
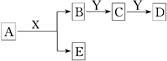
(1)若组成X的元素均为短周期元素,且A、B均为气体,其在相同条件下体积 比为1:1,产物之间可以发生如图的反应(变化中的水略去)。写出有关反应的离子反应方程式:①_______________________________。
(2)若A为红色固体,A可以与Y的浓溶液反应生成一种与A的摩尔质量相同的气体。
①写出该电解过程中阳极的电极反应式:___________________;
②某学生电解一定浓度的X溶液一段时间后,向所得溶液中加入0.1molACO3后,恢复到电解前的浓度和pH(不考虑CO2溶解),则电解过程中转移的电子数为_______。
(3)若向X的溶液中加入过量的稀盐酸,产生白色沉淀,且存在如下的转化关系:
Ⅰ. A+Y(浓)→X+C(气体)+H2O;Ⅱ. A+Y(稀)→X+D(气体)+H2O;Ⅲ. M+O2→D(气体)+H2O。
①已知:组成M气体的两种元素质量比为14:3,则检验M的方法是___________________;
②在标准状况下,27gA溶于一定浓度的Y溶液时,产生2.8L气体,将装有该气体的量筒倒立于有水的水槽中,再通入_______L气体B,水才能恰好充满量筒。
(1)① Cl-+ClO-+2H+=Cl2↑+H2O;(2)①4OH--4e-=2H2O+O2↑;②0.2NA或1.204×1023 ;
(3)①用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②1.4L。
解析试题分析:(1)①根据题意可知:X是NaCl,A是H2;B是Cl2;Y是NaOH;U是NaClO;W是HCl;①反应的离子反应方程式是:Cl-+ClO-+2H+=Cl2↑+H2O;(2)若A为红色固体,A可以与Y的浓溶液反应生成一种与A的摩尔质量相同的气体。则A是Cu,Y是浓硫酸,X是CuSO4;①在该电解CuSO4溶液的过程中,由于OH-放电能力大于SO42-,所以在阳极放电的是OH-,阳极的电极反应式是:4OH--4e-=2H2O+O2↑;②某学生电解一定浓度的X溶液一段时间后,向所得溶液中加入0.1molCuCO3后,恢复到电解前的浓度和pH(不考虑CO2溶解),则由于0.1molCuCO3能够发生反应消耗0.1mol的硫酸,根据电解反应方程式2CuSO4+2H2O 2Cu+O2↑+2H2SO4可知:电解过程中产生0.1mol的硫酸,转移的电子数为0.2NA。(3)根据题意可知:X是AgNO3;Y是HNO3;A是Ag;B是O2;C是NO2;D是NO ; M是NH3,①已知:组成M气体的两种元素质量比为14:3,则M是NH3,检验M的方法是用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②在标准状况下,27gAg的物质的量是 27g÷108g/mol=0.25mol,溶于一定浓度的Y溶液时,产生2.8L NO2与NO的混合气体,将装有该气体的量筒倒立于有水的水槽中,再通入一定气体B,水才能恰好充满量筒。则在反应过程中Ag失去的电子与氧气得到的电子的物质的量相等。则(v/22.4)×4=0.25;解得V=1.4L。
2Cu+O2↑+2H2SO4可知:电解过程中产生0.1mol的硫酸,转移的电子数为0.2NA。(3)根据题意可知:X是AgNO3;Y是HNO3;A是Ag;B是O2;C是NO2;D是NO ; M是NH3,①已知:组成M气体的两种元素质量比为14:3,则M是NH3,检验M的方法是用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②在标准状况下,27gAg的物质的量是 27g÷108g/mol=0.25mol,溶于一定浓度的Y溶液时,产生2.8L NO2与NO的混合气体,将装有该气体的量筒倒立于有水的水槽中,再通入一定气体B,水才能恰好充满量筒。则在反应过程中Ag失去的电子与氧气得到的电子的物质的量相等。则(v/22.4)×4=0.25;解得V=1.4L。
考点:考查元素及化合物的推断、物质的性质、转化、气体的检验、守恒方法在计算中的应用的知识。

已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是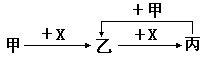
| A.甲为C,X是O2 | B.甲为SO2,X是NaOH溶液 |
| C.甲为Cl2,X为Fe | D.甲为Al,X为NaOH溶液 |
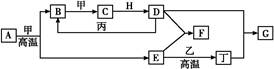
下面是有关物质的转化关系图,其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。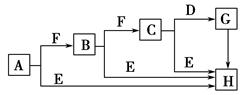
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
(3)C和E反应生成H的离子方程式为__________________,反应中氧化剂与还原剂的物质的量之比为______。
 ,下列说法不正确是
,下列说法不正确是