题目内容
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。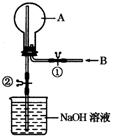
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式: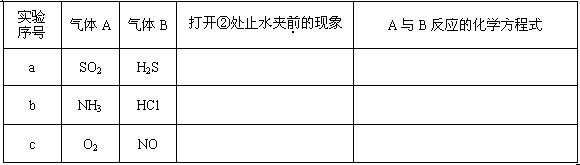
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
(12分,每空2分) (1) (2) C实验
序号气体A 气体B 打开②处止水夹前的现象 A与B反应的化学方程式 a SO2 H2S 产生淡黄色固体 2H2S + SO2 =" 3S↓+" 2H2O b NH3 HCl 冒白烟 NH3 + HCl = NH4Cl c O2 NO 有红棕色气体生成 2NO + O2 = 2NO2
解析

练习册系列答案
相关题目
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
 :
:
|
②反应II的离子方程式为 ▲ 。
③加入饱和KOH溶液的目的是 ▲ 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ▲ ,____▲______。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 ▲ 。
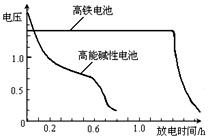
(4)高铁电池是正在研制中的可充电干电池
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。 (共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: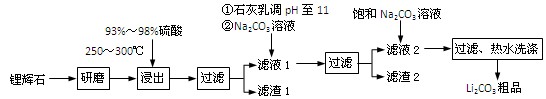
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。


