题目内容
【题目】如图为元素周期表的一部分: 
请参照元素①一⑨在周期表表中的位置,用化学用语回答下列问题:
(1)写出元素⑥在周期表中的位置是 .
(2)元素⑤、⑧、⑨的离子半径由大到小的顺序为 .
(3)元素①④⑨形成原子个数比1:1:1化合物的电子式为;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
(4)元素⑤和⑥最高价氧化物水化物反应的离子方程式为 .
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应的化学方程式为 , 若反应中有6.02×1023个电子发生转移,则生成的气体标准状况下的体积为L.
(6)写出一个方程式,证明元素⑧的非金属性比元素⑨弱: .
【答案】
(1)第三周期第ⅢA族
(2)S2﹣>Cl﹣>Na+
(3)![]() ;
;![]()
(4)OH﹣+Al(OH)3=AlO2﹣+2H2O
(5)C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O;16.8
2SO2↑+CO2↑+2H2O;16.8
(6)Cl2+H2S=S+2HCl
【解析】解:(1)⑥为Al元素,原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为 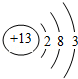 ,位于周期表中第三周期第ⅢA族,所以答案是:第三周期第ⅢA族;(2)电子层一样多的原子,核电荷数越多半径越小,Na+为10电子离子,S2﹣和Cl﹣均为18电子阴离子,故S2﹣>Cl﹣ , Na+为2个电子层,故半径小于Cl﹣ , 即S2﹣>Cl﹣>Na+ , 所以答案是:S2﹣>Cl﹣>Na+;(3)元素①④⑨以原子个数比1:1:1形成的化合物为HClO,分子中O原子与Cl原子、H原子之间分别形成1对共用电子对,其结构式为H﹣O﹣Cl,电子式为:
,位于周期表中第三周期第ⅢA族,所以答案是:第三周期第ⅢA族;(2)电子层一样多的原子,核电荷数越多半径越小,Na+为10电子离子,S2﹣和Cl﹣均为18电子阴离子,故S2﹣>Cl﹣ , Na+为2个电子层,故半径小于Cl﹣ , 即S2﹣>Cl﹣>Na+ , 所以答案是:S2﹣>Cl﹣>Na+;(3)元素①④⑨以原子个数比1:1:1形成的化合物为HClO,分子中O原子与Cl原子、H原子之间分别形成1对共用电子对,其结构式为H﹣O﹣Cl,电子式为: ![]() ,元素⑤和⑧形成硫化钠,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为:
,元素⑤和⑧形成硫化钠,硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ![]() .所以答案是:
.所以答案是: ![]() ;
; ![]() ;(4)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程方程式为:OH﹣+Al(OH)3=AlO2﹣+2H2O,所以答案是:OH﹣+Al(OH)3=AlO2﹣+2H2O;(5)②的单质与⑧的最高价氧化物水化物浓溶液反应,浓硫酸具有强的氧化性,与碳发生反应生成二氧化碳、二氧化硫和水.反应的化学方程式:C+2H2SO4(浓)
;(4)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程方程式为:OH﹣+Al(OH)3=AlO2﹣+2H2O,所以答案是:OH﹣+Al(OH)3=AlO2﹣+2H2O;(5)②的单质与⑧的最高价氧化物水化物浓溶液反应,浓硫酸具有强的氧化性,与碳发生反应生成二氧化碳、二氧化硫和水.反应的化学方程式:C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O,该反应中C(0→+4),每生成3mol气体转移4mol电子,若反应中有6.02×1023个电子发生转移,n=
2SO2↑+CO2↑+2H2O,该反应中C(0→+4),每生成3mol气体转移4mol电子,若反应中有6.02×1023个电子发生转移,n= ![]() =
= ![]() =1mol,则生成0.75mol气体,则生成的气体标准状况下的体积为V=nVm=0.75mol×22.4L/mol=16.8L,所以答案是:C+2H2SO4(浓)
=1mol,则生成0.75mol气体,则生成的气体标准状况下的体积为V=nVm=0.75mol×22.4L/mol=16.8L,所以答案是:C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O;16.8L;(6)氯气能氧化硫化氢生成硫单质,反应方程式为Cl2+H2S=S+2HCl,非金属性S<Cl,所以答案是:Cl2+H2S=S+2HCl.
2SO2↑+CO2↑+2H2O;16.8L;(6)氯气能氧化硫化氢生成硫单质,反应方程式为Cl2+H2S=S+2HCl,非金属性S<Cl,所以答案是:Cl2+H2S=S+2HCl.
