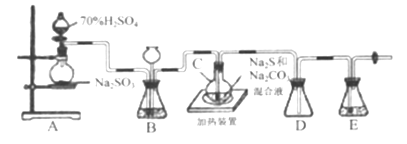
题目内容
【题目】实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如下图所示)。
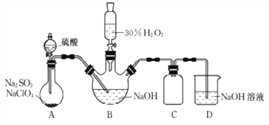
已知:
(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3·3H2O,高于38℃时析出晶体是NaClO2;
(Ⅱ)30 % H2O2超过40℃时会完全分解;
(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置A发生的反应中,还原剂是________。
(2)①装置B中反应生成NaClO2的化学方程式为____________。
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有________、_______。
(3)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。
①在55 ℃时蒸发结晶;②_______;③ ________;④________;得到成品。
(4)装置C的作用是______________。
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性的实验方案是________。(可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
【答案】 Na2SO3 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 缓慢滴加硫酸、H2O 装置B加冷水浴等 趁热(不低于38℃)过滤 用38~60℃热水洗涤 低于60℃干燥 防止D中的溶液倒吸到B瓶(或安全瓶)中 加热至40℃至60℃之间除去H2O2,冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性。
【解析】(1)装置A发生的反应是:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+ H2O其中Na2SO3中硫的化合价从+4价升高为+6价,Na2SO3作为还原剂;
(2)①装置B中2ClO2在NaOH和H2O2的作用下反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可以通过缓慢滴加硫酸、H2O而不致温度过高,或在装置B加冷水浴等;
(3)从装置B反应后的溶液中获得NaClO2晶体的操作步骤为:① 在55 ℃时蒸发结晶;②趁热(不低于38℃)过滤;③用38~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)装置D中气体反应,装置内压强降低,装置C防止倒吸;
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性,除去H2O2的干扰后,选择FeCl2溶液,氧化后生成FeCl3,再选择KSCN溶液用于检验产生的FeCl3,实验方案是:加热至40℃至60℃之间除去H2O2,冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性。

【题目】室温下,下列有关两种溶液的说法不正确的是( )
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A. ①②两溶液中c(OH-)相等
B. ①溶液的物质的量浓度为0.01mol·L-1
C. ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②