题目内容
KOH和KHCO3固体的混合物25.6 g,于250 ℃进行煅烧,冷却后混合物质量损失了4.9 g。
(1)求起始混合物的百分组成。
(2)若混合物的质量损失改为2.1 g,这时起始混合物的百分组成又是多少?
(1)求起始混合物的百分组成。
(2)若混合物的质量损失改为2.1 g,这时起始混合物的百分组成又是多少?
21.875%和78.125%;45.6%和54.4%。
用“差量法”判断谁过量。
假设25.6 g混合物是由KOH和KHCO3恰好完全反应的质量比混合而成的,则
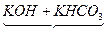
 K2CO3+H2O 差量
K2CO3+H2O 差量
156 18
25.6 g x
经计算,求得理论差量x="2.95" g。
题目中,第一种情况实际差量>2.95 g,为KHCO3过量。由“钾守恒”,残留的固体25.6 g-4.9 g="20.7" g为K2CO3,则通过列二元方程组,可求得KOH和KHCO3固体各自的质量。题目中,第二种情况实际差量<2.95 g,为KOH过量,由方程式运算可直接求得KHCO3的质量。
假设25.6 g混合物是由KOH和KHCO3恰好完全反应的质量比混合而成的,则
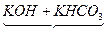
 K2CO3+H2O 差量
K2CO3+H2O 差量156 18
25.6 g x
经计算,求得理论差量x="2.95" g。
题目中,第一种情况实际差量>2.95 g,为KHCO3过量。由“钾守恒”,残留的固体25.6 g-4.9 g="20.7" g为K2CO3,则通过列二元方程组,可求得KOH和KHCO3固体各自的质量。题目中,第二种情况实际差量<2.95 g,为KOH过量,由方程式运算可直接求得KHCO3的质量。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
 、K
、K