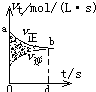题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.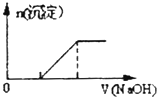
向O.1mo1﹣L﹣1该物质的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
【答案】C
【解析】A.[(NH4)2Fe(SO4)2中含有Fe2+,Fe2+可被Cl2氧化而不能大量共存,故A不符合题意;
B.滴加NaOH溶液,首先Fe2+先与OH﹣反应生成白色沉淀,图象错误,故B不符合题意;
C.滴入几滴KSCN溶液,若溶液变红色,说明Fe2+被氧化为Fe3+,故C符合题意;
D.恰好使S042﹣完全沉淀的离子方程式为:2NH4++Fe2++2SO42﹣+3Ba2++4OH﹣═2BaSO4↓+Fe(OH)2↓+2NH3↑+2H2O,故D不符合题意;
故答案为:C.
A.亚铁离子能被氯气氧化为铁离子;
B.亚铁离子与氢氧化钠反应生成白色氢氧化亚铁沉淀后铵根离子再反应;
C.根据三价铁离子的检验方法进行判断;
D.根据反应物的物质的量关系判断离子方程式正误.

练习册系列答案
相关题目