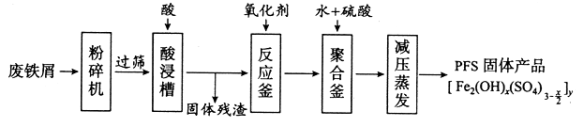
题目内容
【题目】如图为元素周期表中部分元素某种性质![]() 值
值![]() 随原子序数变化的关系。
随原子序数变化的关系。

(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是______![]() 填元素符号
填元素符号![]() 。
。
(2)同周期,随着原子序数的增大,X值变化趋势为______再结合同主族不同元素的X值变化的特点,体现了元素性质的______变化规律。
(3)X值较小的元素集中在元素周期表的______![]() 填序号
填序号![]()
A.左下角![]() 右上角
右上角![]() 分界线附近
分界线附近
(4)下列关于元素此性质的说法中正确的是______![]() 填序号
填序号![]() 。
。
A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值的大小可用来衡量元素金属性和非金属性的强弱
(5)SiHCl3与水发生的化学反应可认为是广义的水解反应,根据图中数据,该反应的化学方程式为______
【答案】O、Mg 逐渐增大 周期性 A BC ![]()
【解析】
(1)p能级最多容纳6个电子,s能级最多容纳2个电子,结合原子核外电子排布规律分析;
(2)根据图示曲线变化分析同主族、同周期X的变化规律;
(3)根据图示可知,周期表中X较小的元素集中在左下角;
(4)此变化规律可以判断两元素的金属性或非金属性强弱;
(5)结合图示中X值判断各元素化合价,然后分析反应产物并写出化学方程式。
(1)p能级最多容纳6个电子,s能级最多容纳2个电子,则短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素的核外电子排布式为![]() 、
、![]() ,分别为O、Mg元素,
,分别为O、Mg元素,
故答案为:O、Mg;
(2)根据图示可知,同周期随着原子序数的增大,X值逐渐增大,同主族从上至下,对应的X值减小,体现了元素性质的周期性变化规律,
故答案为:逐渐增大;周期性;
(3)同周期,X值左边小,同一主族,X值下边小,所以周期表中X较小的元素集中在左下角,故A正确,
故答案为:A;
(4)A、X值可代表电负性,无法根据X值判断元素最高正化合价,故A错误;
B、X值可代表电负性,X值越大非金属性越强,能够反映原子在分子中吸引电子的能力,故B正确;
C、X值越大金属性越弱、非金属性越强,X值的大小可用来衡量元素金属性和非金属性的强弱,故C正确;
故答案为:BC;
(5)X值可代表电负性,X值越大非金属性越强,根据图示可知,非金属性:![]() ,则
,则![]() 中Si为
中Si为![]() 价,H、Cl元素为
价,H、Cl元素为![]() 价,
价,![]() 与水反应时,Si元素生成
与水反应时,Si元素生成![]() 或
或![]() ,
,![]() 价H元素与水分子中
价H元素与水分子中![]() 价H生成氢气,该反应方程式为:
价H生成氢气,该反应方程式为:![]() 或
或![]() ,
,
故答案为:![]() (或
(或![]() )。
)。