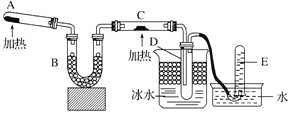
题目内容
【题目】将22.4g铁粉逐渐加入到含HNO3 0.8mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是( )
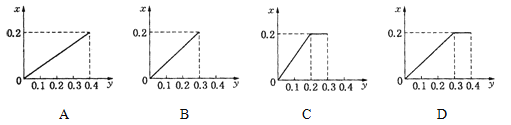
【答案】C
【解析】
试题分析:22.4g铁粉的物质的量为n(Fe)=22.4g÷56g/mol=0.4mol,假设铁完全反应需硝酸的物质的量为n,则:Fe+4HNO3(稀)=Fe(NO3)3 +NO↑+H2O
1 4
0.4mol n
1:4=0.4mol:n,解得n=1.6mol,由于1.6mol>0.8mol,所以Fe有剩余,根据硝酸计算生成NO的物质的量,参加反应生成NO的Fe的物质的量,则:
Fe+4HNO3(稀)=Fe(NO3)3 +NO↑+H2O
1mol 4 mol 1mol
0.2mol 0.8mol 0.2mol
最多产生NO的物质的量是0.2mol,此时反应产生Fe(NO3)3物质的量是0.2mol,后发生反应2Fe(NO3)3 +Fe=3 Fe(NO3)2 ,由于Fe(NO3)3物质的量是0.2mol,所以反应又消耗Fe粉0.1mol,此后就不再发生反应,用图像表示为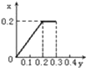 ,选项C正确。
,选项C正确。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】己知:S2O32-+2H+= SO2↑+S↓+H2O。探究化学反应速率的影响因素,以下实验浑浊出现最快的组别是
组别 | 温度/℃ | 0.1 mol·L-1 Na2S2O3/mL | 0,1 mol·L-1 H2SO4/mL | 水/mL |
A | 30 | 10 | 10 | 0 |
B | 30 | 5 | 5 | 10 |
C | 25 | 10 | 5 | 5 |
D | 25 | 5 | 10 | 5 |
A. A B. B C. C D. D
【题目】除去下列物质中少量杂质所需除杂试剂及方法不正确的是
物质(杂质) | 除杂试剂 | 除杂方法 | |
A | 乙醇(水) | CaO | 蒸馏 |
B | 淀粉溶液(NaCl) | ——— | 渗析 |
C | CO2(HCl) | NaOH溶液 | 洗气 |
D | NaCl溶液(I2) | CCl4 | 萃取分液 |