题目内容
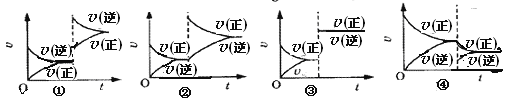
【题目】在下列平衡体系中,保持温度一定时,改变某一物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A. 2NO+O2![]() 2NO2 B. Br2(g)+H2
2NO2 B. Br2(g)+H2 ![]() 2HBr
2HBr
C. N2O4 ![]() 2NO2 D. 6NO+4NH3
2NO2 D. 6NO+4NH3 ![]() 5N2+3H2O
5N2+3H2O
【答案】B
【解析】
A.反应前后气体体积不等,则改变压强,平衡发生移动,故A不选;B.反应前后气体体积相等,则改变压强,平衡不发生移动,如果加入Br2,或H2 混合气体的颜色会改变;改变压强时,颜色也会改变,故选B; C.反应前后气体体积不等,则改变压强,平衡发生移动,故C不选; D.因气体均没有颜色,改变某物质的浓度,颜色不会加深,故D不选; 所以答案为:B。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH的变化的曲线是_______。

(2)用H2表示从0~2s内该反应的平均速率v(H2)=___________________。
(3)该反应达到最大限度时CO的转化率为___________。
(提示:转化率=![]() ×100%)
×100%)
(4)能说明该反应已达到平衡状态的是______。
a. CO与H2的浓度保持不变 b. 容器内密度保持不变
c. 容器内压强保持不变 d. 每消耗1molCH3OH的同时有2mol H–H形成
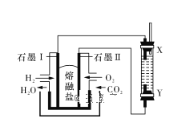
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如下图所示,图中CH3OH从______(填A或B)通入。

【题目】Ⅰ、在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)列式近似计算该反应在298K的平衡常数___________。
(2)如果增大氯气的压强,平衡将向______________移动。
Ⅱ、甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1)![]() HCOOH(l)+CH3OH(1) △H>0
HCOOH(l)+CH3OH(1) △H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
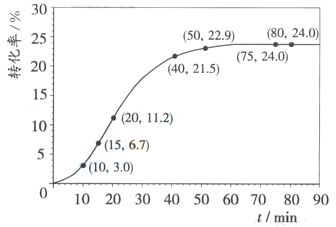
(3)请计算15~20min范围内甲酸甲酯的减少量为____________________mol
(4)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
平均反应速率 /(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
依据以上数据,出该反应的反应速率在不同阶段的变化规律:________,其原因是:_________ 。
(5)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。__________