题目内容
(15分)有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2 个电子层,它们能生成无色无味的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)元素名称是: A______B______C______D_____E________。
(2)C元素位于第________周期,第________族
(3)B的最高价氧化物与E的最高价氧化物对应水化物反应
的离子方程式:
(4)A和D的化合物与C和D的化合物(DC2)能否反应?
若能反应写出反应方程式。
(1)元素名称是: A______B______C______D_____E________。
(2)C元素位于第________周期,第________族
(3)B的最高价氧化物与E的最高价氧化物对应水化物反应
的离子方程式:
(4)A和D的化合物与C和D的化合物(DC2)能否反应?
若能反应写出反应方程式。
(1)氢、碳、氧、硫、钾(每空1分) (2)二 VIA(每空1分)
(3)CO2+2OH-=CO32-+H2O 或 CO2+OH-= HCO3- (3分)
(4)能(2分)2 H2S+SO2=3S↓+2H2O(3分)
(3)CO2+2OH-=CO32-+H2O 或 CO2+OH-= HCO3- (3分)
(4)能(2分)2 H2S+SO2=3S↓+2H2O(3分)
考查元素周期表的结构阳极原子核外电子排布。只有氢元素的原子才有可能没有中子,所以A是H。元素B和C都有2 个电子层,属于第二周期,它们能生成无色无味的气体BC2,气体是CO2,所以B是C,C是O。元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2,所以D是S,气体是SO2。E的阳离子E+的电子层结构与Ar的电子层结构相同,Ar的原子序数是18,则E是K。A和D的化合物与C和D的化合物(DC2)分别是H2S和SO2,其中S的化合价分别为-2价和+4价,所以二者可以发生氧化还原反应,生成酯基价态的单质硫,方程式为2 H2S+SO2=3S↓+2H2O。

练习册系列答案
相关题目
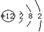

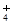 、NH
、NH