题目内容
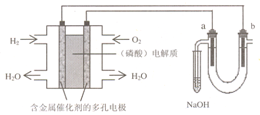 用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,正极反应式为:O2+2H2O+4e-?4OH- | B、电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | D、忽略能量损耗,当电池中消耗0.02g H2时,b 极周围会产生0.02g H2 |
分析:左边能自发的进行氧化还原反应,为原电池,氢气失电子发生氧化反应,则通入氢气的电极是负极,通入氧气的电极是正极,正极上氧气得电子发生还原反应;
右边是电解池,a是阳极,b是阴极,阳极上溴离子放电,阴极上氢离子放电,电子从负极流向阴极,从阳极流向正极.
右边是电解池,a是阳极,b是阴极,阳极上溴离子放电,阴极上氢离子放电,电子从负极流向阴极,从阳极流向正极.
解答:解:A.酸性介质中,氢氧燃料电池中阳极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-═2H2O,故A错误;
B.还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Br-而不是Cl-,所以还原性:Br->Cl-,故B正确;
C.电解时,电子流动路径是:负极→外电路→阴极,阳极→外电路→正极,故C错误;
D.根据转移电子相等知,当电池中消耗0.02g H2时,b 极周围会产生0.02g H2,故D正确;
故选:BD.
B.还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Br-而不是Cl-,所以还原性:Br->Cl-,故B正确;
C.电解时,电子流动路径是:负极→外电路→阴极,阳极→外电路→正极,故C错误;
D.根据转移电子相等知,当电池中消耗0.02g H2时,b 极周围会产生0.02g H2,故D正确;
故选:BD.
点评:本题考查了原电池和电解池,明确原电池和电解池原理是解本题关键,知道离子的放电顺序,易错选项是C,注意电子不进入电解质溶液,溶液中阴阳离子定向移动而形成电流,难度不大.

练习册系列答案
相关题目