题目内容
已知钠能与水剧烈反应:2Na+2H2O=2NaOH+H2↑
(1)相同质量的Na,Mg,Al与过量的盐酸反应,在相同的状况下,三者置换出的H2的体积比是________。
(2)相同物质的量的Na,Mg,Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积比是________。
(3)Na,Mg,Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,则Na,Mg,Al三种金属的物质的量之比是________。
(4)将Na,Mg,Al各0.3mol分别投入到含0.1mol HCl的盐酸中,同温同压下产生气体的体积比是________。
36︰69︰92 1︰2︰3 6︰3︰2 3︰1︰1
(1)钠、镁和铝在反应中分别失去1、2、3个电子,所以在质量相同的条件下生成的氢气体积之比是1/23︰1/24×2︰1/27×3=36︰69︰92。
(2)钠、镁和铝在反应中分别失去1、2、3个电子,所以在物质的量相同的条件下生成的氢气体积之比是1︰2︰3。
(3)钠、镁和铝在反应中分别失去1、2、3个电子,所以在生成的氢气体积相等的条件下,三种金属的物质的量之比是6︰3︰2。
(4)钠极易与水反应,所以0.3mol钠生成0.15mol氢气。镁和铝在与盐酸的反应中,金属是过量的,所以生成的氢气都是0.05mol,则氢气的体积之比是3︰1︰1。
(1)钠、镁和铝在反应中分别失去1、2、3个电子,所以在质量相同的条件下生成的氢气体积之比是1/23︰1/24×2︰1/27×3=36︰69︰92。
(2)钠、镁和铝在反应中分别失去1、2、3个电子,所以在物质的量相同的条件下生成的氢气体积之比是1︰2︰3。
(3)钠、镁和铝在反应中分别失去1、2、3个电子,所以在生成的氢气体积相等的条件下,三种金属的物质的量之比是6︰3︰2。
(4)钠极易与水反应,所以0.3mol钠生成0.15mol氢气。镁和铝在与盐酸的反应中,金属是过量的,所以生成的氢气都是0.05mol,则氢气的体积之比是3︰1︰1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
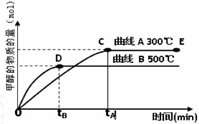
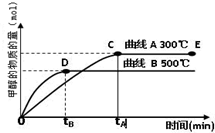 (2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.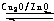 CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示: