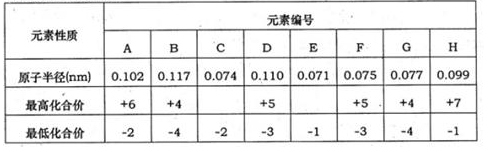
题目内容
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
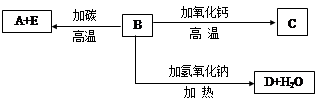
请填空:
(1)形成单质A的原子的结构示意图为 ,它的最高化合价为 。
(2)B的化学式(分子式)为 。B和碳反应生成A和E的化学方程式是 。
(3)C的化学式(分子式)为 ,D晶体中化学键类型有 。
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示) 。

请填空:
(1)形成单质A的原子的结构示意图为 ,它的最高化合价为 。
(2)B的化学式(分子式)为 。B和碳反应生成A和E的化学方程式是 。
(3)C的化学式(分子式)为 ,D晶体中化学键类型有 。
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示) 。
(1)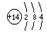 +4
+4
(2) SiO2 2C+SiO2 2CO↑+Si
2CO↑+Si
(3) CaSiO3 离子键、极性键
(4)SiO32-+CO2+H2O=H2 SiO3+CO32-
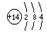 +4
+4 (2) SiO2 2C+SiO2
 2CO↑+Si
2CO↑+Si (3) CaSiO3 离子键、极性键
(4)SiO32-+CO2+H2O=H2 SiO3+CO32-
试题分析:A为地壳含量仅次于氧的非金属元素的单质,故A为Si,B、C、D、E分别为 SiO2、CaSiO3、NaSiO3、CO。所以(1)形成单质A的原子的结构示意图为
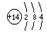 ,最高化合价为+4 ,(2)B的化学式(分子式)为SiO2,B和碳反应生成A和E的化学方程式是2C+SiO2
,最高化合价为+4 ,(2)B的化学式(分子式)为SiO2,B和碳反应生成A和E的化学方程式是2C+SiO2 2CO↑+Si ,注意是CO不是CO2,3)C的化学式(分子式)为CaSiO3 ,D为NaSiO3,其晶体中化学键类型有离子键、极性键;(4)可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2 SiO3+CO32-。
2CO↑+Si ,注意是CO不是CO2,3)C的化学式(分子式)为CaSiO3 ,D为NaSiO3,其晶体中化学键类型有离子键、极性键;(4)可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2 SiO3+CO32-。点评:本题考查了Si及其化合物,是高考的重要考点,该题难度适中。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
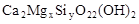 ,该化学式中x, y的值分别是( )
,该化学式中x, y的值分别是( )