题目内容
请你运用所学的化学知识判断,下列有关的叙述错误的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源.保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
B
只要正当、适量的使用食品添加剂,对人体是无害的,答案为B

练习册系列答案
相关题目


 :
:
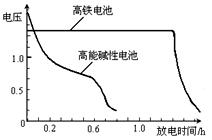
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。 2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
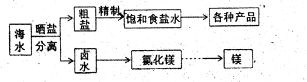
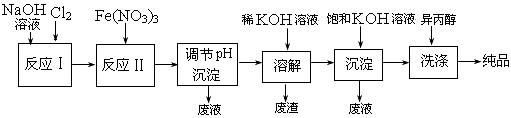
 镁制取镁的化学方程式
镁制取镁的化学方程式 : 。
: 。 。
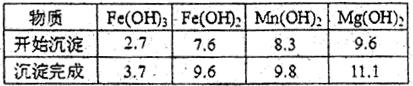
。 2+、
2+、 Mg
Mg 2+、SO
2+、SO ,加入试剂的合理顺序为
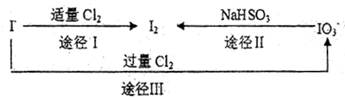
,加入试剂的合理顺序为  、溴、碘
、溴、碘