��Ŀ����
����Ŀ����ij�ݻ�һ�����ܱ������У������п��淴Ӧ��A��g��+B��g��xC��g����Hδ֪����ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ���ǣ�T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾC������������� �� 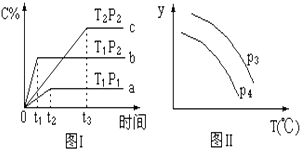
A.P3��P4 �� y���ʾA��ת����
B.P3��P4 �� y���ʾB���������
C.P3��P4 �� y���ʾ���������ܶ�
D.P3��P4 �� y���ʾ��������ƽ��Ħ������
���𰸡�D
���������⣺����ͼ����a��b�����λ��֪���ȹ���ƽ��ѹǿ����ѹ����p2��p1����C%���ߣ�ƽ��������й�x=1����b��c�����λ��֪���ȹ���ƽ���¶ȸߴ����£���ΪT1��T2����C%���ͣ�������ӦΪ���ȷ�Ӧ�����÷�ӦΪ��A��g��+B��g��C��g��������ӦΪ���ȷ�Ӧ�����ɷ�Ӧʽ��֪�����ºͽ�ѹ����ʹ��Ӧ���淴Ӧ�����ƶ� A�����ڸ÷�Ӧ�������С�ķ�Ӧ������ѹǿ��ƽ��������У�A��ת����������P3��P4 �� ��A����
B�����ڸ÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������У�B�İٷֺ������ߣ�ͼ���ϣ���B����
C�����ڸ÷�Ӧǰ�����������غ㣬����������䣬�����ܶ�һֱ���䣬��C����
D�����ڸ÷�Ӧ�������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ʵ�����С�����������غ㣬����ƽ����Է�������������P3��P4 �� �����¶ȣ�ƽ�������ƶ�������ƽ����Է���������С��ͼ����ϣ���D��ȷ��
��ѡD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ��
��1��ʵ�����ϱ��д�С�����ձ�����ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β����������0.5molL��1���ᡢ0.55molL��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ���� ��
��2��ʵ�����ܷ��û���ͭ˿��������滷�β��������������ܡ�������ԭ���� ��
��3�����Ǽ�¼��ʵ���������£�
ʵ����Ʒ | ��Һ�¶� | �к��� | ||
t1 | t2 | ��H | ||
�� | 50 mL0.55 molL��1NaOH��Һ | 20�� | 23.3�� | |
50 mL0.5 molL��1HCl��Һ | ||||
�� | 50 mL0.55 molL��1NaOH��Һ | 20�� | 23.5�� | |
50 mL0.5 molL��1HCl��Һ | ||||
��֪��Q=cm��t2��t1������Ӧ����Һ�ı�����cΪ4.18J����1g��1 �� �����ʵ��ܶȾ�Ϊ1gcm��3 ��
�ټ�������ϱ���H=������2λС������
�ڸ���ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ�� ��
��4������KOH����NaOH���Բⶨ�������С����ޡ���Ӱ�죻���ô������HCl��ʵ�飬�Բⶨ�����С����ޡ���Ӱ�죮

