题目内容
【题目】下表是元素周期表的一部分。
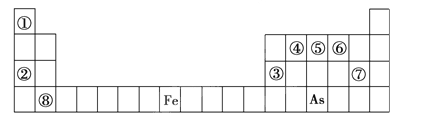
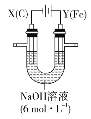
已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):

(1)⑧的元素符号是______。
(2)⑤与As两种元素中,非金属性较强的是______(填元素符号)。
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是______________________。
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是________。
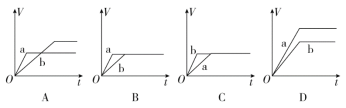
(5)若A为红棕色气体,则A、X、D的化学式分别为________、________、________。
【答案】 Ca N ![]()
![]() NO2 Fe Fe(NO3)2
NO2 Fe Fe(NO3)2
【解析】由元素在周期表的位置可知,①为H、②为Na、③为Al、④为C、⑤为N、⑥为O、⑦为Cl、⑧为Ca;
(1)元素⑧的最高价氧化物的水化物为氢氧化钙,化学式为Ca(OH)2;
(2)⑤是N,与As在同一主族,根据同主族元素由上到下非金属性减弱,所以非金属性较强的是N;
(3)电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小,则②⑥⑦三种元素的简单离子半径由大到小是Cl->O2->Na+;
(4)元素③的单质与②的最高价氧化物对应的水化物反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)A为红棕色气体,可确定A是NO2,E是NO,B为硝酸,则X是Fe,C为硝酸铁、D为硝酸亚铁,则A、C、D的化学式分别为NO2、Fe、Fe(NO3)2。

练习册系列答案
相关题目