��Ŀ����
����Ŀ��������ˮ��Һ�п��ܴ��ڵ���ƽ�⡢ˮ��ƽ��ͳ����ܽ�ƽ�⣺
��1��ʵ����0.1molL��1һԪ����HA ��pHΪ4����HA�ĵ���ƽ�ⳣ��Ka=
��2����AlCl3��Һ��������������ù���Ϊ���ѧʽ����
��3��NaHCO3��Һ�д��ڵ�ƽ������������ֱ������ӷ���ʽ��ʾ��H2OH++OH������ ��
��4�������ʵ���Ũ�ȵ�NH4HSO4��Һ��NH4Cl��Һ��Ƚϣ�c��NH4+����ǰ�����ߣ����������������=������
��5����֪298Kʱ��Mg��OH��2���ܶȻ�����Ksp=5.6��10��12 �� ��0.1molL��1MgCl2��Һ�μ��ռ���Һ��pH=11����ʱc��Mg2+��= molL��1 ��
���𰸡�
��1��10��7mol?L��1
��2��Al2O3
��3��HCO3��?H++CO32���� HCO3��+H2O?H2CO3+OH��
��4����
��5��5.6��10��6
���������⣺��1��ʵ����0.1molL��1һԪ����HA ��pHΪ4����HA�ĵ���ƽ�ⳣ��Ka= ![]() molL��1=10��7molL��1��
molL��1=10��7molL��1��
���Դ��ǣ�10��7molL��1�� ��2���Ȼ���Ϊǿ�������Σ�Al3+����ˮ�⣬ˮ��ķ���ʽΪAl3++3H2OAl��OH��3+3H+��ˮ�����Һ�����ԣ����ɺ����չ����У�HCl�ӷ���Al��OH��3���ȶ�������ʱ�ֽ�����Al2O3��
���Դ��ǣ�Al2O3 ����3����NaHCO3��Һ����̼��������ӵ�ˮ��ƽ��Ϊ��HCO3��+H2OH2CO3+OH��������ƽ�⣺HCO3��H++CO32����ˮ�ĵ���ƽ��H2OH++OH����̼���������ˮ��̶ȴ��ڵ���̶ȵ�����Һ�Լ��ԣ�
���Դ��ǣ�HCO3��H++CO32���� HCO3��+H2OH2CO3+OH������4��NH4HSO4������������笠�����ˮ�⣬NH4Cl��ǿ�������Σ�笠�������ˮ�������c��NH4+����ǰ�ߣ����ߣ�
���Դ��ǣ�������5����0.1molL��1MgCl2��Һ�μ��ռ���Һ��pH=11��c��OH����= ![]() =10��3mol/L����֪298Kʱ��Mg��OH��2���ܶȻ�����Ksp=c��Mg2+��c2��OH����=5.6��10��12����ʱc��Mg2+��=
=10��3mol/L����֪298Kʱ��Mg��OH��2���ܶȻ�����Ksp=c��Mg2+��c2��OH����=5.6��10��12����ʱc��Mg2+��= ![]() =5.6��10��6��
=5.6��10��6��
���Դ��ǣ�5.6��10��6��
�����㾫����������Ҫ���������������ˮ��Һ�еĵ���ƽ������֪ʶ�㣬��Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ��������ȷ�����⣮

����Ŀ��(һ)ʯ�ͷ�����Եõ����͡������ǵͷе�������Ļ���������е�̼ԭ����һ����C5��C12��Χ�ڣ������飬�����ʽΪ________�������������ʽ�Ľṹ��_____�֣�����ij�ֽṹ��һ�ȴ���ֻ��һ�֣�д���������������ĸ������Ľṹ��ʽ__________��
(��)ʯ���ѽ�ɻ��A����֪A��ͨ��״������һ����Է�����Ϊ28�����壬Aͨ���Ӿ۷�Ӧ���Եõ�F��F����ΪʳƷ��װ���IJ��ϡ��л���A��B��C��D��E��F������ͼ�Ĺ�ϵ��

��֪�� ��
��
(1)A�ķ���ʽΪ________��F������______________��
(2)д��ָ����Ӧ�Ļ�ѧ����ʽ����ע����Ӧ����
��Ӧ | ��Ӧ����ʽ | ��Ӧ���� |
�� | _______ | _______ |
�� | _______ | _______ |
�� | _______ | _______ |
����Ŀ������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С��������ͼװ�úϳ�����ȩ�������ķ�Ӧ���£�![]() ��
��

��Ӧ��Ͳ������������б����£�
�е�/�� | �ܶ�/��gcm-3�� | ˮ���ܽ��� | |
������ | 117.2 | 0.8109 | �� |
����ȩ | 75.7 | 0.8017 | �� |
��֪��ȩ���ɱ�����Na2Cr2O7������
ʵ�鲽�����£�
��6.0gNa2Cr2O7����100mL�ձ��У���ˮ30mL�ܽ⣬�ٻ�������5mLŨ���ᣬ��������ҺС��ת����B�С���A�м���4.0g�������ͼ�����ʯ�����ȡ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90��95�棬��E���ռ�90�����ϵ���֡�������ﵹ���Һ©���У���ȥˮ�㣬�л������������ռ�75��77����֣�����2.0g���ش��������⣺
��1��ʵ���У��ܷ�Na2Cr2O7��Һ�ӵ�Ũ�����У�˵������__________________��
��2�������ʯ��������______________�������Ⱥ���δ�����ʯ��Ӧ��ȡ����ȷ��ʩ��______________________________��
��3������װ��ͼ�У�B������������_____________��D������������_______________��
��4����Ӧ�¶�Ӧ������90��95�棬��ԭ����___________________________��
��5���¶ȼ�C1������_________________��C2������_______________��
��6����ʵ���У�����ȩ�IJ���Ϊ_________����
����Ŀ��ijѧ����0.2000molL��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£� ��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�۵���Һ������0����0���̶������£������¶�����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ����д�����ǣ����ţ� �� �ô�������ᵼ�²ⶨ������ƫ����ƫС������Ӱ�족�� ��
��2���жϵζ��յ�������ǣ� ��
��3����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪmL�� ![]()
��4�������������ݣ���������������Һ��Ũ�ȣ�mol/L��
�ζ����� | ���������mL�� | ���ռ������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
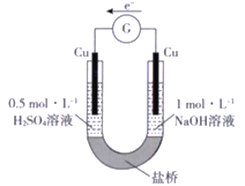
����Ŀ���о�С��������±���ʾ��ԭ���ʵ��:
ʵ���� | �� | �� |
ʵ��װ�� |
|
|
ʵ������ | ����װ��5 ���Ӻ�����������ָ������ƫת������ͭƬ��������������� | �����Ƭ��������������ݣ�����װ��5 ���Ӻ�����������ָ������ƫת���Ҳ���Ƭ�������������� |
���й��ڸ�ʵ��������У���ȷ����
A. ��װ�õ������У������Ӿ����Ҳ��ƶ�
B. ʵ�����У�����ͭ����ʴ
C. ʵ�����У����缫�ĵ缫��ӦʽΪ2H++ 2e-=H2��
D. ʵ���� ��ʵ�����У�����O2 �õ��ӵķ�Ӧ����