题目内容
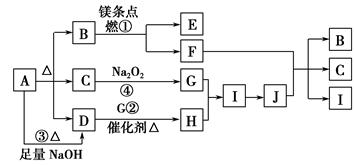
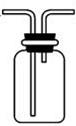
某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
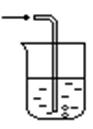
(1)乙同学认为甲同学的结论是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用 。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 。
(1)乙同学认为甲同学的结论是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用 。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 。
(1)4HNO3 4NO2↑+O2↑+2H2O(2分) CO2(1分)
4NO2↑+O2↑+2H2O(2分) CO2(1分)
(2)④(2分)
(3)常温下存在平衡体系:2NO2 N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2。(3分)
N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2。(3分)
(4)C中溶液变浑浊(或产生白色沉淀) (3分) 4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O(3分)
 4NO2↑+O2↑+2H2O(2分) CO2(1分)
4NO2↑+O2↑+2H2O(2分) CO2(1分)(2)④(2分)
(3)常温下存在平衡体系:2NO2
 N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2。(3分)
N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2。(3分)(4)C中溶液变浑浊(或产生白色沉淀) (3分) 4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O(3分)
试题分析:(1)浓硝酸受热易分解产生二氧化氮气体,4HNO3
 4NO2↑+O2↑+2H2O;若C与浓硝酸反应应有二氧化碳气体生成,所以检验CO2的产生来证明碳与浓硝酸反应;
4NO2↑+O2↑+2H2O;若C与浓硝酸反应应有二氧化碳气体生成,所以检验CO2的产生来证明碳与浓硝酸反应;(2)只要存在浓硝酸被加热的情况都有可能产生二氧化氮气体,不能证明是C与浓硝酸发生了反应,所以最合理的操作是④;
(3)常温下存在平衡体系:2NO2
 N2O4,该反应为放热反应,所以降低温度,平衡正向移动,N2O4被液化,从而除去NO2;
N2O4,该反应为放热反应,所以降低温度,平衡正向移动,N2O4被液化,从而除去NO2;(4)若C与浓硝酸反应则有二氧化碳生成,与氢氧化钡溶液反应生成白色沉淀;C的溶液中还含有少量氮元素,只以NO3-形式存在,说明混合气体中仍有NO2,与氢氧化钡溶液、氧气反应生成硝酸钡溶液,化学方程式为4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O。

练习册系列答案
相关题目





 6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g)ΔH1="+3" 359.26 kJ·mol-1 20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
20Cu3P +24H3PO4+60H2SO4 6 mol CuSO4能氧化白磷的物质的量是 。
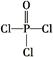 )与季戊四醇(
)与季戊四醇(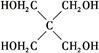 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。