题目内容
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
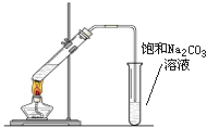
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是:_______;
(2)乙酸乙酯在饱和碳酸钠溶液的_______层;(填“上”或“下”)
(3)浓硫酸的作用是______________;
(4)制取乙酸乙酯的化学方程式是______,该反应属于___ (填反应类型)反应;
(5)饱和碳酸钠的作用是:________________;
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
【答案】先加乙醇再加浓硫酸最后加乙酸 上 催化剂和吸水剂 CH3CH2OH+CH3COOH![]() CH3COOCH3CH3+H2O 酯化反应 中和酸溶解醇降低乙酸乙酯的溶解度 ①③
CH3COOCH3CH3+H2O 酯化反应 中和酸溶解醇降低乙酸乙酯的溶解度 ①③
【解析】
(1)结合浓硫酸的稀释的方法分析解答;
(2)乙酸乙酯的密度小于水,且不溶于水;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(5)碳酸钠能够与乙酸反应,乙醇易溶于水,碳酸钠的存在可以降低乙酸乙酯在水中的溶解度;
(6)根据化学平衡的特征分析判断。
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,方法为:先在大试管中加入乙醇,然后慢慢向其中注入浓硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,故答案为:先加乙醇再加浓硫酸最后加乙酸;
(2)乙酸乙酯的密度小于水,且不溶于水,因此乙酸乙酯在饱和碳酸钠溶液的上层,故答案为:上;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,故答案为:催化剂和吸水剂;
(4)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O;酯化反应;
CH3COOC2H5+H2O;酯化反应;
(5)饱和碳酸钠溶液的主要作用是中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,故答案为:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度;
(6)①混合物中各物质的浓度不再变化,为平衡的特征,可知达到平衡状态,故①选;②单位时间里,生成1mol乙醇,同时生成1mol乙酸,不能体现正、逆反应速率关系,不能判定平衡状态,故②不选;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,可知正、逆反应速率相等,为平衡状态,故③选;故答案为:①③。