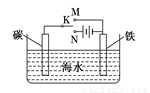
题目内容
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
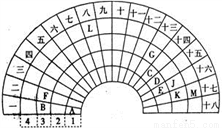
(1)E代表的元素处于常见周期表的位置是___________。G的离子结构示意图_____________。
(2)CE2的电子式是__________________。
(3)元素A和M形成的化合物的水溶液与元素K的单质反应的离子方程式为:__________________。反应后,向溶液中加入CK4溶剂,振荡后现象为____________________。
下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,该入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃捧蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
A. A B. B C. C D. D
4种短周期元素在周期表中的相对位置如图所示,Y元素原子最外层电子数是其电子层数的3倍。下列说法中,正确的是
X | Y | |
Z | W |
A. X的氢化物可用作制冷剂
B. Y与氢元素形成的物质中只含有极性共价键
C. 4种元素的原子半径最大的是W
D. 4种元素中Z的最高价氧化物对应水化物的酸性最强
(12分)图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
元素编号 | A | B | C | D | E |
电负性 | 3.0 | 2.5 | X[ | 1.5 | 0.9 |
原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
(2)X的值应为 (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系 ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是: (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:


 H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是