题目内容
【题目】亚硝酸和亚硝酸盐在生产、医药等领域有着广泛应用。某校化学兴趣小组用下图所示仪器(夹持装置已省略)及药品,探究硫酸与亚硝酸钠反应生成气体的成分。已知NO2和NO液化温度分别为21 ℃和-152 ℃。
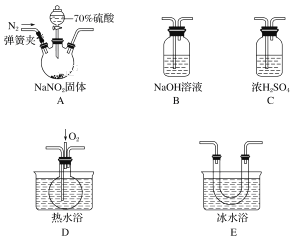
(1)A中盛放70%硫酸的仪器名称为___________________,反应前通入氮气的目的是_______________________________________________;仪器的连接顺序(按左→右连接)为A→________→________→________→B;
(2)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体含有NO,依据的现象是__________________________________;
(3)装置A中反应的化学方程式为________________________________;
(4)如果没有装置C,对实验结论造成的影响是________________________。
【答案】 分液漏斗 排尽装置内的空气,防止产生的NO被氧化成NO2,造成对A中反应产物检验的干扰 C E D 装置D中通入氧气后会出现红棕色气体 2NaNO2+H2SO4===Na2SO4+NO↑+NO2↑+H2O 水蒸气会与NO2反应产生NO,造成对NO的来源认识不清
【解析】(1)根据仪器构造可知A中盛放70%硫酸的仪器名称为分液漏斗;硫酸与亚硝酸钠反应生成气体的成分为NO、NO2,其中NO与空气中的氧气反应被氧化成NO2,所以实验开始前要将装置中的空气排尽,反应前通入氮气的目的是排尽装置内的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰,根据各部分装置的作用可知,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以仪器的连接顺序为A→C→E→D→B;(2)无色的NO与氧气反应生成红棕色的二氧化氮,所以确认A中产生的气体含有NO,依据的现象是装置D中通入氧气后会出现红棕色气体;(3)装置A中为硫酸与亚硝酸钠反应生成硫酸钠、NO、NO2和水,反应方程式为2NaNO2+H2SO4=Na2SO4+NO↑+NO2↑+H2O;(4)C装置主要作用是干燥混合气体,如果有水,二氧化氮与水反应生成一氧化氮,所以如果没有装置C,水蒸气会与NO2反应产生NO,造成对NO的来源认识不清。