题目内容
【题目】请按要求回答下列问题.
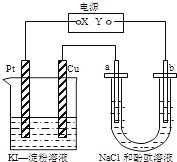
(1)根据图1回答①②: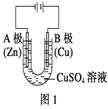
①A电极可观察到的现象是 , 电极反应式为;B极的电极反应式为 .
②通电一段时间后,CuSO4溶液的浓度 , pH(填“变大”、“变小”或“不变”).
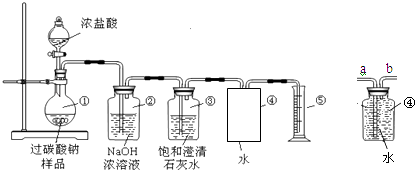
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为 , 电解反应的离子方程式为 .
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积L.
【答案】
(1)锌极镀上一层红色物质;Cu2++2e﹣═Cu;Cu﹣2e﹣═Cu2+;不变;不变
(2)4OH﹣﹣4e﹣═2H2O+O2↑;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;0.175a
2Cu+O2↑+4H+;0.175a
【解析】(1)①为电解池,Cu为阳极不断溶解,电极反应式为:Cu﹣2e﹣═Cu2+ , Zn为阴极,铜离子在阴极放电生成Cu,锌极镀上一层红色的铜,电极方程式为Cu2++2e﹣═Cu。②该池为电镀池,电解质溶液浓度不变,pH不变; (2)③电镀时,石墨为阳极,发生氧化反应,电极方程式为4OH﹣﹣4e﹣═2H2O+O2↑,生成氧气,铜为阴极,总反应式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
④铜电极增重a g,n(Cu)= ![]() mol,转移
mol,转移 ![]() mol电子,由可知4OH﹣﹣4e﹣═2H2O+O2↑,生成n(O2)=
mol电子,由可知4OH﹣﹣4e﹣═2H2O+O2↑,生成n(O2)= ![]() ×
× ![]() mol,则体积为
mol,则体积为 ![]() ×
× ![]() mol×22.4L/mol=0.175aL,
mol×22.4L/mol=0.175aL,

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】如表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
物质 | 杂质 | 除杂试剂或操作方法 | |
A | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
B | NaNO3 | CaCO3 | 溶解、过滤 |
C | CO2 | O2 | 通入NaOH溶液,洗气 |
D | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
A.A
B.B
C.C
D.D