题目内容
11.实验室用含碳酸钙90%的石灰石100g与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应).(1)生成的氯化钙的物质的量是多少?
(2)生成标准状况下的二氧化碳的体积是多少?
分析 发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,含碳酸钙90%的石灰石100g,则碳酸钙质量为90g,求出碳酸钙的物质的量,设生成的氯化钙的物质的量y,根据方程式中定量关系计算.
解答 解:含碳酸钙90%的石灰石100g,则碳酸钙质量为90g,碳酸钙的物质的量为$\frac{90g}{100g/mol}$=0.9mol,
设生成的氯化钙的物质的量x,CO2的体积为VL,
CaCO3 +2HCl=CaCl2+H2O+CO2↑
1mol 1mol 22.4L
0.9mol xmol VL
x=0.9mol,
V=$\frac{0.9mol×22.4L}{1mol}$=20.16L;
答:(1)生成的氯化钙的物质的量是0.9mol;
(2)生成标准状况下的二氧化碳的体积是20.16L.
点评 本题考查化学方程式的有关计算,关键是理解方程式中各个物理量之间的关系,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
1.室温下,下列各组离子在指定溶液中一定大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- | |
| C. | 甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
19.沸点最低的一种烷烃x和它的同系物y以2﹕1的摩尔比混合,混合气的密度与x相邻同系物相等,则y的结构式可能是( )
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3CH2CH (CH3)2 | D. | CH3CH (CH3)2 |
6.以下实验能获得成功的是( )
| A. | 把银氨溶液和少量乙醛加入试管中再酒精灯上加热制银镜 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
16.某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
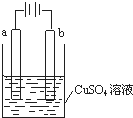

| A. | 若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-═Cu | |
| B. | 若a和b为铜,通电后a电极有气体产生 | |
| C. | 若a为铜,b为铁,通电后Cu2+向a电极移动 | |
| D. | 若a为粗铜,b为纯铜,通电后b电极质量增加 |
3.高铁电池是一种新型可充电碱性电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时负极反应式为:Zn-2e-=Zn2+ | |
| B. | 放电时每转移3mol电子,正极有2 mol K2FeO4被还原 | |
| C. | 放电时正极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| D. | 放电时正极附近溶液的碱性减弱 |


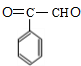 +2H2$\stackrel{一定条件}{→}$
+2H2$\stackrel{一定条件}{→}$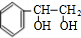 .
.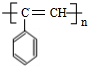 ,
,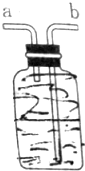 如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入.
如图所示装置,用排空气法收集O2,O2应由b(填“a”或“b”下同)口进入,检验O2是否收集满的操作是将带火星的木条靠近a,如果带火星木条复燃,证明氧气收集满;若想用排水法收集O2,可将装置中充满水,O2由a口进入.