题目内容
(8分)亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:

(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)

(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
(1)
 (2分) B(1分)
(2分) B(1分)(2)80.0(1分) 500ml容量瓶 胶头滴管(1分)
(3)酚酞溶液或
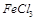 溶液等(1分) (4)A(1分)
溶液等(1分) (4)A(1分)(5)加热浓缩、冷却结晶、过滤(1分)
试题分析:
(1)
 ,ClO3-中氯元素为+5价,遇到具有还原性的SO2反应做氧化剂,化合价降低,根据图意生成ClO2,而SO2中S价态升高,生成SO42-;鼓入空气的作用是稀释ClO2,而A的反应需要加催化剂,而C选项,需要还原剂。
,ClO3-中氯元素为+5价,遇到具有还原性的SO2反应做氧化剂,化合价降低,根据图意生成ClO2,而SO2中S价态升高,生成SO42-;鼓入空气的作用是稀释ClO2,而A的反应需要加催化剂,而C选项,需要还原剂。(2)根据公式计算,m=n*M=C*V*M=80g ;容量瓶必须标明量程。而没有标准的450ml的容量瓶,而选用500ml配置。胶头滴管用于定容。
(3)检验碱是否过量用酸碱指示剂,或者用氢氧化铁,现象为有红褐色沉淀。
(4)在吸收塔中需要氧化剂,过氧化钠与双氧水氧化性能相似。
(5)从溶液中得到晶体的一般过程为加热浓缩,冷却结晶,过滤。
点评:本题综合性比较强,结合化工生产的流程图,所考查的知识点不难,知识点比较零散,需要学生有较强的知识基础和综合能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是