题目内容
【题目】在化学反应中,反应前与反应后相比较,肯定不变的是
①元素的种类 ②原子的种类 ③分子数目 ④原子数目
⑤反应前物质的质量总和与反应后物质的质量总和
⑥如果在水溶液中反应,则反应前与反应后阳离子所带的正电荷总数
⑦反应前反应物的总能量与反应后生成物的总能量
A. ①②③④⑦ B. ①②④⑤ C. ①②⑤⑥⑦ D. ②③⑤⑥⑦
【答案】B
【解析】
根据质量守恒定律的内容:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。再根据其意义:元素的种类、原子的种类和数目、物质的总质量在反应前后不变;一定改变的是物质的种类与分子的种类、物质的总能量,可能改变的是分子数目、阳离子所带的正电荷总数,故选B。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:
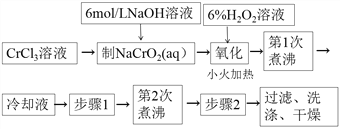
除图中标注的试剂外,实验中还用到6mol·L-1 醋酸,0.5 mol·L-1 Pb(NO3)2溶液,pH 试纸。
已知:①部分物质性质如下
物质 | 性质 | 颜色 | 溶解性 |
Cr(OH)3 | 两性氢氧化物 | 绿色 | 难溶于水 |
Pb(NO3)2 | - | 无色 | 易溶于水 |
Pb(CH3COO)2 | - | 无色 | 易溶于水 |
PbCrO4 | - | 黄色 | 难溶于水 |
Pb(OH)2 | 弱碱性 | 白色 | PH=7.2开始沉淀 ;PH=8.7完全沉淀 |
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
③六价铬在溶液中物种分布分数与pH关系如下图所示。
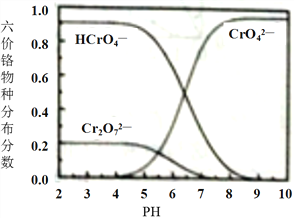
(1)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是______。
(2)“氧化”时发生反应的离子方程式为______。
(3)下列说法正确的是(______)
A.两次煮沸的目的不相同
B.步骤2可以先加入一滴0.5mol·LPb(NO3)2溶液搅拌片刻,待产生少量沉淀后,继续滴加至有大量沉淀产生。
C.静置后,向上层清液中继续滴入Pb(NO3)2溶液,若无沉淀生成,则说明滴加完全。
D.小火加热的目的是为了避免反应过快。
(4)步骤1为__________________________________________________________。
(5)为测定产品的纯度,可用先用硝酸溶解PbCrO4,然后用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Pb2+ + Y4- =PbY2-。测定时,先称取0.5000g无水PbCrO4产品,溶解后,用0.05000 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水PbCrO4产品的纯度是_________(以质量分数表示)。