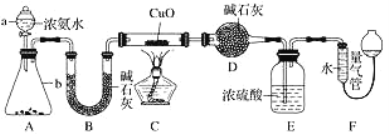
��Ŀ����
����Ŀ��Li������Ĺ������������Li��Ϊ�������ϵĵ�ؾ���С���ᡢ�����ܶȴ���������ܣ��õ��㷺Ӧ�á��ش��������⣺
(1)����Liԭ�ӵ����Ų�ͼ��ʾ��״̬�У��ǻ�̬ԭ�ӵ����Ų�ͼ����________(����)������(�ɵ͵���)���ڵڶ�λ����__________(����)��
A��![]()
B��![]()
C��![]()
D��![]()
(2)Li+��H-������ͬ�ĵ��ӹ��ͣ�r(H-)______r(Li+)(����������������)��LiAlH4�У�������_________(����)��
A�����Ӽ� B������ C������ D�����
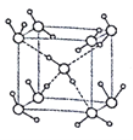
(3)Li2O�����Ӿ��壬�侧���ܿ�ͨ��ͼ(a)��Bormi��Haberѭ������õ���

��֪��Li2O������Ϊ________kJmol��1��Liԭ�ӵĵ�һ������Ϊ_______kJmol��1��O=O������Ϊ________kJmol��1��
(4)Li2O������ͼ��ʾ��1����������Li+______����O2-_______����

���𰸡�D A > CD 2908 520 498 8 4
��������
��1��������͵�״̬ӦΪ��̬����Ϊ1s22p1������Խ�ߵ�״̬Ӧ�������ϸ��ܼ��и���ĵ��ӣ���������(�ɵ͵���)���ڵڶ�λ����A���ʴ�Ϊ��D��A��
��2��Li+�ĺ����������H-��ͬ���ڵ��ӽṹ��ͬ������£��˵����Խ��������Խǿ�����Ӱ뾶ԽС������r(H-)��r(Li+)��LiAlH4Ϊ���ӻ��������Li+��AlH4-���ʴ������Ӽ���AlH4-��Al��H��������ϣ�����LiAlH4�в����ڵ���������������ʴ�Ϊ��>��CD��
��3��������Ϊ����̬�����γ�1mol����ų����������ʾ�����Ϊ2908kJmol��1����ͼ��2Li(����)![]() 2Li(g)
2Li(g)![]() 2Li+(g)���̣�������Ϊ1mol����̬ԭ�ӱ�Ϊ+1�������ӵ������������һ������Ϊ
2Li+(g)���̣�������Ϊ1mol����̬ԭ�ӱ�Ϊ+1�������ӵ������������һ������Ϊ![]() kJmol��1=520kJmol��1����ͼ��
kJmol��1=520kJmol��1����ͼ��![]() O2(g)
O2(g)![]() 2O(g)Ϊ
2O(g)Ϊ![]() molO=O�ļ��ܣ���O=O������Ϊ249kJmol��1��2=498kJmol��1���ʴ�Ϊ��2908��520��498��
molO=O�ļ��ܣ���O=O������Ϊ249kJmol��1��2=498kJmol��1���ʴ�Ϊ��2908��520��498��
��4���ɾ����Ľṹ��֪��Liȫ���ھ������ڲ�������1�������к���8��Li+��O�ֱ�λ�ھ����Ķ�������ģ����ݾ�����ԭ�ӵġ���̯�����ɼ���1��������O2-�ĸ���Ϊ��8��![]() +6��
+6��![]() =4���ʴ�Ϊ��8��4��
=4���ʴ�Ϊ��8��4��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�