题目内容
【题目】请将下列反应的双线桥写出
(1)8H++2NO3﹣+3Cu=Cu 2++2NO↑+4H2O
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O.
【答案】
(1)解:反应中铜元素0价变化为+2价,3mol铜反应失去电子为6mol,氮元素化合价+5价变化为+2价,2mol硝酸根离子失电子生成NO,得到6mol电子则电子转移的方向和数目为 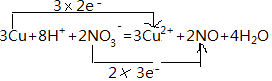 ,
,
答:反应的双线桥表示的氧化还原反应为 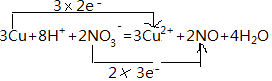
(2)解:在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由﹣1价升高到0价,被氧化,既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 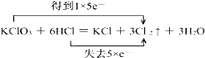 ,
,
答:反应的双线桥表示的氧化还原反应为 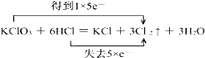
【解析】氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,(1)反应中铜元素0价变化为+2价,3mol铜反应失去电子为6mol,氮元素化合价+5价变化为+2价,2mol硝酸根离子失电子生成NO,得到6mol电子;(2)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、﹣1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

