题目内容
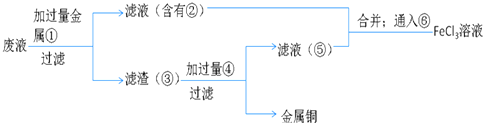
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂:试剂①___________;试剂③___________。
(2)判断试剂①已过量的方法是:_______________________。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉__________(填“能”或“不能”)透过半透膜;SO42-___________(填“能”或“不能”)透过半透膜。
(4)操作④的名称是________________。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,用托盘天平称量的氯化钠固体的质量是___________,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有_____________。
(6)分析以下操作对配制的溶液浓度造成的影响,影响偏高的是____________________。
①蒸馏水洗完容量瓶后没有烘干
②转移溶液过程中出现漏液
③溶解后未经冷却就转移到容量瓶
④定容时俯视
⑤摇匀后发现液面降低,再加蒸馏水
【答案】 BaCl2 HCl 静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量 不能 能 蒸发结晶 29.3g 500ml容量瓶 ③④
【解析】本题主要考查氯化钠的提纯方法。
(1)试剂①用来除去![]() ,是氯化钡溶液;试剂③用来除去
,是氯化钡溶液;试剂③用来除去![]() 、H+,是盐酸。
、H+,是盐酸。
(2)判断试剂①已过量的方法是:静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
(3)操作①是利用半透膜进行分离提纯,胶体微粒不能透过半透膜,水分子、离子可以透过半透膜,操作①的实验结果:淀粉不能透过半透膜;SO42-能透过半透膜。
(4)氯化钠的溶解度随着温度升高变化缓慢,从溶液得到晶体需要蒸发结晶,操作④的名称是蒸发结晶。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,需用500mL容量瓶配制溶液,用托盘天平称量的氯化钠固体的质量是1.0mol/×0.5L×58.5g/mol=29.3g,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有500mL容量瓶。
(6)①对配制的溶液浓度没有影响;②溶质损失,使配制的溶液浓度偏低;③冷却后溶液体积减小,配制的溶液浓度偏高;④溶液体积变小,配制的溶液浓度偏高;⑤溶液体积增大,配制的溶液浓度偏低。故选③④。