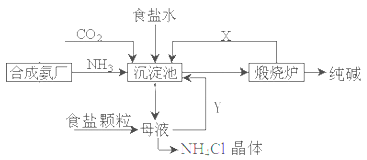
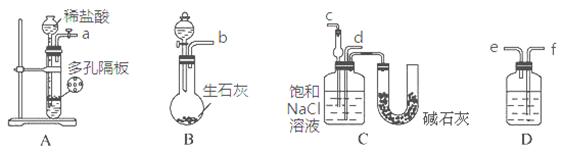
题目内容
下列有关元素化合物的叙述中正确的是
| A.钠在空气中燃烧生成白色的氧化钠固体 |
| B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 |
| C.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色 |
| D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物 |
BC
试题分析:A.钠在空气中燃烧成过氧化钠,是淡黄色,错误;B.利用Fe3++3SCN-=Fe(SCN)3,生成的Fe(SCN)3显血红色,而Fe2+则没有这样的性质,正确;C.二氧化硫溶于水生成亚硫酸使石蕊试液变红,但不能使其褪色,正确;D.普通玻璃的成分是硅酸三钙、硅酸二钙、铝酸三钙,是混合物,错误。

练习册系列答案
相关题目
 4NO + 6H2O
4NO + 6H2O