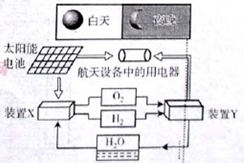
题目内容
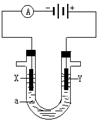
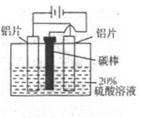
下图是模拟电化学反应的装置图。下列有关叙述中,错误的是
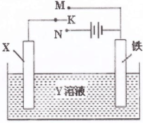

| A.X为碳棒,Y为NaCl溶液,开关K置于N处,溶液中阳离子移向碳棒 |
| B.X为锌棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,该法称为牺牲阳极的阴极保护法 |
| C.X为铜棒,Y为CuSO4溶液,开关K置于M处,铜棒质量将增加,外电路中的电子流向铜棒 |
| D.X为铜棒,Y为CuSO4溶液,开关K置于N处,铁棒质量将增加,溶液中Cu2+浓度不会改变 |
AB
试题分析:开关置于N处时,X作电解NaCl溶液的阳极,铁作阴极,内电路中阳离子移向阴极,而非阳极,故A错误;外加电源的电解池中,锌棒作被腐蚀的阳极,铁是受保护的阴极,这就是外加电源的阴极保护法,而非牺牲阳极的阴极保护法,故B错误;开关K置于M处,铜棒作原电池的正极,铁作负极,则外电路中电子流向铜棒,内电路CuSO4溶液中的Cu2+移到正极上发生还原反应,析出单质铜覆盖在铜棒上,铜棒质量增加,故C正确;开关置于N处时,铜棒作阳极,反应为Cu-2eˉ==Cu2+,铁作阴极,CuSO4溶液中的Cu2+移到阴极上发生还原反应:Cu2++2eˉ==Cu,则铁棒质量增加,阴极消耗Cu2+的量等于阳极生成Cu2+的量,因此溶液中Cu2+的浓度保持不变,故D正确。

练习册系列答案
相关题目

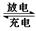 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)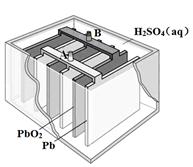
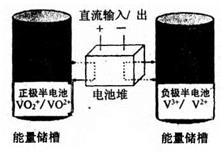
 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。