题目内容
(9分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH—、C1—、CO32—、NO3—、SO4— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物。
试回答下列问题:
(1)写出A溶液与E溶液反应的化学方程式: _________。
(2)写出E溶液与过量的B溶液反应的离子方程式: ____。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1) △H=-akJ·mol-1。请写出B与C的稀溶液反应的热化学方程式: _____________________。
(1)3Na2CO3+Al2(SO4)3+3H2O =2Al(OH)3↓+3CO2↑+3Na2SO4(3分)
(2)2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O(3分)
(3)OH-(aq)+H+(aq)=H2O(1) △H=-a kJ/mol
或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1) △H=-a kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1) △H=-2a kJ/mol(3分,物质聚集状态、反应热任一方面错都不给分)
【解析】
试题分析:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸,E为硫酸铝。
(1)碳酸钠与硫酸铝发生双水解反应,化学反应方程式为:3Na2CO3+Al2(SO4)3+3H2O =2Al(OH)3↓+3CO2↑+3Na2SO4
(2)硫酸铝和过量的氢氧化钡反应,铝离子和硫酸根之间按照物质的量之比是2:3,即2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓,
(3)氢氧化钡为强碱,盐酸为强酸,则B与C的稀溶液反应的热化学方程式为:
OH-(aq)+H+(aq)=H2O(1);△H=-a kJ/mol
或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1);△H=-a kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1);△H=-2a kJ/mol
考点:考查离子反应的推断、离子共存问题、双水解问题、离子方程式的书写等。
点评:本题考查知识点较多,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、热化学反应方程式、离子反应等知识来解答。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案(9分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH—、C1—、CO32—、NO3—、SO4— |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物。
试回答下列问题:
(1)写出A溶液与E溶液反应的化学方程式: _________。
(2)写出E溶液与过量的B溶液反应的离子方程式: ____。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1) △H=-akJ·mol-1。请写出B与C的稀溶液反应的热化学方程式: _____________________。
 ,
, 。
。
 A)时,A为: ;
A)时,A为: ; ,
, 。
。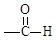
 。
。