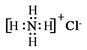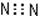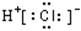题目内容
在反应3Cl2+8 NH3 = N2+6NH4Cl中,氧化剂与还原剂的物质的量之比为( )
| A.8:3 | B.3:8 | C.3:2 | D.1:3 |
C
试题分析:在反应3Cl2+8 NH3 = N2+6NH4Cl中:氯元素由反应前Cl2的0价变为反应后NH4Cl的-1价,化合价降低,得到电子,作氧化剂;氮元素由反应前NH3中的-3价变为反应后N2中的0价,化合价升高,失去电子作还原剂。在参加反应的8个NH3中有2个被氧化,起还原剂的作用。故氧化剂与还原剂的物质的量之比为3:2。选项为C。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目

 ;
;
 Cl
Cl