题目内容
由NO、H2、CO2组成的混合气体通过过量的Na2O2后引燃,使其充分反应,得到浓度为70%的硝酸溶液(无任何气体剩余).混合气体中各气体的体积比为( )A.1:2:3
B.2:3:6
C.2:4:7
D.1:4:7
【答案】分析:涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=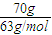 =
=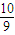 mol,n(H2O)=
mol,n(H2O)=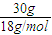 =
=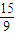 mol,根据方程式结合质量守恒计算.
mol,根据方程式结合质量守恒计算.
解答:解:涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,
得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=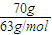 =
=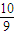 mol,n(H2O)=
mol,n(H2O)= =
=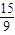 mol,
mol,
则 4NO+3O2+2H2O=4HNO3
4 3 2 4
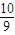 mol n1(O2)n(H2O)
mol n1(O2)n(H2O)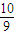 mol
mol
所以n(NO)=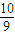 mol,
mol,
n(H2)=n(H2O)= mol+
mol+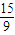 mol=
mol=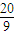 mol,
mol,
2H2+O2=2H2O
2 1 2
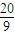 mol
mol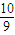 mol
mol
n(O2)= mol+
mol+ ×
×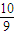 mol=
mol=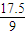 mol,
mol,
2Na2O2+2CO2=2Na2CO3+O2
2 1
n(CO2)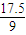 mol
mol
n(CO2)=2×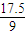 mol=
mol=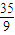 mol,
mol,
则n(NO):n(H2):n(CO2)=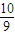 mol:
mol: mol:
mol: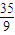 mol=2:4:7,
mol=2:4:7,
故选C.
点评:本题考查混合物的计算,题目难度较大,本题注意根据反应的化学方程式,从质量守恒的角度解答.
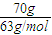 =
=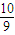 mol,n(H2O)=
mol,n(H2O)=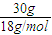 =
=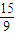 mol,根据方程式结合质量守恒计算.
mol,根据方程式结合质量守恒计算.解答:解:涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,
得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=
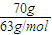 =
=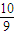 mol,n(H2O)=
mol,n(H2O)= =
=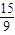 mol,
mol,则 4NO+3O2+2H2O=4HNO3
4 3 2 4
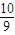 mol n1(O2)n(H2O)
mol n1(O2)n(H2O)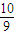 mol
mol所以n(NO)=
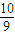 mol,
mol,n(H2)=n(H2O)=
 mol+
mol+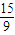 mol=
mol=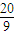 mol,
mol,2H2+O2=2H2O
2 1 2
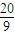 mol
mol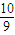 mol
moln(O2)=
 mol+
mol+ ×
×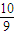 mol=
mol=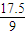 mol,
mol,2Na2O2+2CO2=2Na2CO3+O2
2 1
n(CO2)
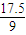 mol
mol n(CO2)=2×
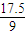 mol=
mol=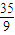 mol,
mol,则n(NO):n(H2):n(CO2)=
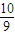 mol:
mol: mol:
mol: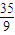 mol=2:4:7,
mol=2:4:7,故选C.
点评:本题考查混合物的计算,题目难度较大,本题注意根据反应的化学方程式,从质量守恒的角度解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目