题目内容
在浓盐酸中HNO2与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2HNO2+6H+===N2↑+3SnCl+4H2O关于该反应的说法中正确的组合是( )
①氧化剂是HNO2 ②还原性:Cl->N2
③每生成2.8 g N2,还原剂失去的电子为0.6 mol ④x为4,y为2 ⑤SnCl是氧化产物
①氧化剂是HNO2 ②还原性:Cl->N2
③每生成2.8 g N2,还原剂失去的电子为0.6 mol ④x为4,y为2 ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
A
试题分析:反应中,HNO2得到电子为氧化剂,SnCl2失去电子为还原剂,其对应产物SnCl是氧化产物。Cl-在反应中没有得失电子。每生成1 mol N2转移6 mol电子,故生成2.8 g N2(0.1 mol),SnCl2失去0.6 mol电子。根据电荷守恒有:-12+6=-3y,y=2,根据原子守恒有:6+12=3x,x=6。综合上述,①③⑤正确,故选A。
点评:本题主要考查氧化还原反应的知识,要求会计算得失电子数以及会判断氧化剂和还原剂、氧化产物和还原产物等。题目较难。

练习册系列答案
相关题目
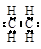

 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式
