题目内容
某温度下, 反应H2(g)+CO2(g)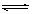 H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数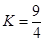 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
|
起始量 |
甲 |
乙 |
丙 |
|
H2 (mol) |
1 |
2 |
2 |
|
CO2(mol) |
1 |
1 |
2 |
下列判断不正确的是
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C. 平衡时, 乙中H2的转化率大于60%
D. 平衡时, 丙中c(H2 ) 是0. 08 mol·L-1
【答案】
C
【解析】根据表中数据可知,甲中物质的浓度最小,反应速率最慢,丙中浓度最大,反应速率最快,A正确。反应前后体积不变,所以甲和丙的平衡是等效的。设转化率设x,则根据甲可知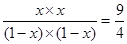 ,解得x=0.6,即转化率是60%,B正确。乙相当于在甲的基础上最大氢气浓度,可以提高CO2的转化率,但氢气转化率降低,C不正确。平衡时丙中氢气是2mol-2mol×0.6=0.8mol,所以浓度是0.08mol/L,D正确,答案选C。
,解得x=0.6,即转化率是60%,B正确。乙相当于在甲的基础上最大氢气浓度,可以提高CO2的转化率,但氢气转化率降低,C不正确。平衡时丙中氢气是2mol-2mol×0.6=0.8mol,所以浓度是0.08mol/L,D正确,答案选C。

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
某温度下,反应H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=
.该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
下列判断不正确的是( )
| 9 |
| 4 |
| 起始量 | 甲 | 乙 | 丙 |
| H2(mol) | 1 | 2 | 2 |
| CO2(mol) | 1 | 1 | 2 |
| A、反应开始时,甲中的反应速率最慢,丙中的反应速率最快 |
| B、平衡时,甲和丙中CO2的转化率相等,均是60% |
| C、平衡时,乙中H2的转化率大于60% |
| D、平衡时,丙中c(H2) 是0.08 mol?L-1 |