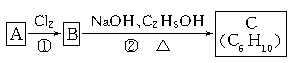题目内容
(10分)石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平。请回答下列问题。
(1)下列物质中,不可以通过乙烯发生加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(3)已知 2CH3CHO+O2
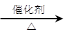 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。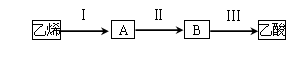
反应II的化学方程式为 。
(4) 某有机物12g完全燃烧,生成7.2gH2O和8.96LCO2(标准状况下),0.5mol此有机物的质量为30g。则该有机物的分子式为 又知此有机物不具有弱酸性,不能与金属钠反应,能与碱溶液反应,试写出其结构简式
(1)B;(2)nCH2=CH2
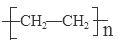 ; 加聚反应;
; 加聚反应;
(3)2CH3CH2OH + O2 2CH3CHO + 2H2O;(4)C2H4O2 ; HCOOCH3。
2CH3CHO + 2H2O;(4)C2H4O2 ; HCOOCH3。
解析试题分析:(1)A.乙烯与氢气发生加成反应产生CH3CH3,正确; B.乙烯不能与任何物质发生反应产生CH3CHCl2,错误;C.乙烯与水发生加成反应产生CH3CH2OH,正确;D.乙烯与HBr发生加成反应产生CH3CH2Br,正确。(2)工业上以乙烯为原料可以通过加聚反应可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为nCH2=CH2
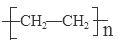 ;(3)乙烯与水发生加成反应产生A:乙醇,乙醇催化氧化产生B:乙醛,反应II的化学方程式为2CH3CH2OH + O2
;(3)乙烯与水发生加成反应产生A:乙醇,乙醇催化氧化产生B:乙醛,反应II的化学方程式为2CH3CH2OH + O2 2CH3CHO + 2H2O;乙醛催化氧化产生乙酸。(4)0.5mol此有机物的质量为30g。则该有机物的相对分子质量是30÷0.5=60。12g该物质的物质的量是12g÷60g/mol=0.2mol。n(H2O)= 7.2g÷18g/mol=0.4mol;n(CO2)= 8.96L÷22.4L/mol=0.4mol。所以1mol的该化合物中含有C:2mol;含有H:4mol,含有O:(60-2×12-4×1)÷16="2." 则该有机物的分子式为C2H4O2 ;因为此有机物不具有弱酸性,不能与金属钠反应,能与碱溶液反应,则其结构简式是HCOOCH3。
2CH3CHO + 2H2O;乙醛催化氧化产生乙酸。(4)0.5mol此有机物的质量为30g。则该有机物的相对分子质量是30÷0.5=60。12g该物质的物质的量是12g÷60g/mol=0.2mol。n(H2O)= 7.2g÷18g/mol=0.4mol;n(CO2)= 8.96L÷22.4L/mol=0.4mol。所以1mol的该化合物中含有C:2mol;含有H:4mol,含有O:(60-2×12-4×1)÷16="2." 则该有机物的分子式为C2H4O2 ;因为此有机物不具有弱酸性,不能与金属钠反应,能与碱溶液反应,则其结构简式是HCOOCH3。
考点:考查有机物的结构、性质、相互转化、分子式、结构简式及化学方程式的书写的知识。

 名校课堂系列答案
名校课堂系列答案分子式为C10H14的二取代芳香烃,其可能的结构有
| A.3种 | B.6种 | C.7种 | D.9种 |
甲烷是以碳原子为中心的正四面体结构而不是正方形的平面结构,其理由是
| A.常温常压下甲烷是气体 | B.二氯甲烷只有一种结构 |
| C.四氯甲烷只有一种结构 | D.三氯甲烷只有一种结构 |
下列性质中,属于烷烃特征的是( )
| A.完全燃烧产物只有二氧化碳和水 |
| B.它们几乎不溶于水 |
| C.分子的通式为CnH2n+2,与氯气发生取代反应 |
| D.它们是非电解质 |