题目内容
现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中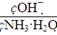 _________(填“增大”“减小”或“不变”)。
_________(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式____________________;所得溶液的pH___ 7(填“<”“>”或“=”),用离子方程式表示其原因_________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH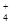 )=a mol/L,则c(SO
)=a mol/L,则c(SO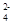 )=__________。
)=__________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___ _______。
(10分)(1)减小
(2)NH3·H2O+H+===NH+H2O <
NH+H2O NH3·H2O+H+
NH3·H2O+H+
(3) mol/L (4)c(NH)>c(SO)>c(H+)>c(OH-)
【解析】
试题分析:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中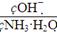 减小。
减小。
(2)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3·H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O NH3.H2O+H+。
NH3.H2O+H+。
(3)溶液呈中性,则溶液中c(H+)=c(OH-)。溶液呈电中性,即溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5amol/l。(4)pH=1的硫酸溶液,c(H+)=0.1mol?L-1,氢离子浓度与氨水浓度相等,体积相同,所以恰好反应生成盐,如果NH4+不水解,c( NH4+):c(SO42-)=2:1,但水解是较弱的,所以c(NH4+)>c(SO42- );溶液呈酸性,所以c(H+)>c(OH-),故溶液中离子浓度大小顺序是c(NH4+)>c(SO42- )>c(H+)>c(OH-)。
考点:考查弱电解质的电离、盐类的水、离子浓度大小的比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。该题的关键是利用好电荷守恒、物料守恒、质子守恒等关系式,有利于培养学生的逻辑推理能力和创新思维能力。
